-
疏水相互作用 编辑
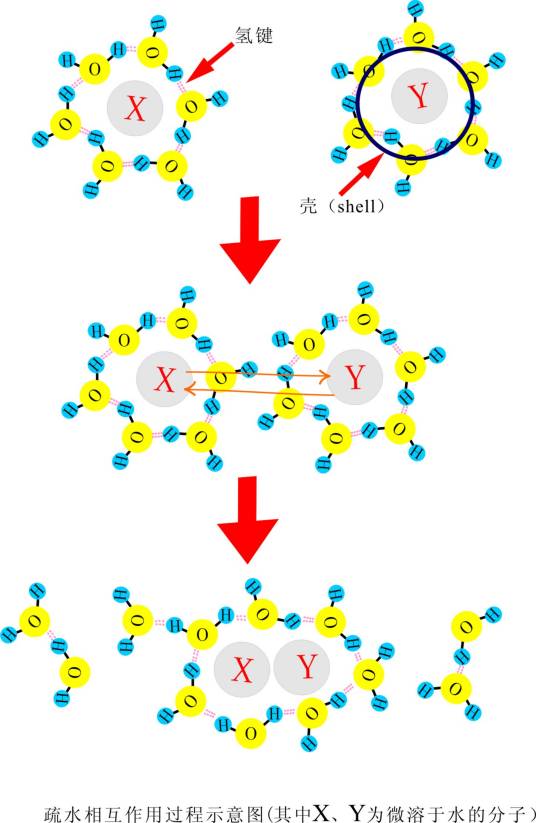
疏水相互作用是蛋白质折叠的主要驱动力。疏水基团彼此靠近聚集以避开水的现象称为疏水相互作用(hydrophobic interaction)。当蛋白质中的疏水侧链聚集蛋白质内部,而不是被水溶剂化时,蛋白质在水中是很稳定的。疏水相互作用在维持蛋白质构象中起着主要的作用,因为水分子彼此之间的相互作用要比水与其他非极性分子的作用更强烈。非极性侧链为避开水而聚集到蛋白质分子内部。与之同时,大多数极性侧链在蛋白质表面维持着与水的接触。分子内部的疏水特性不仅解释了疏水残基的聚集,而且也说明了螺旋和折叠片的稳定。
释义
疏水相互作用是通过疏水物的疏水基与水相互排斥作用而发生的,疏水基一般是非极性基。这种作用使疏水基相互靠拢,同时使水相互集中并更大程度地结构化。
笼状水合物:通过疏水相互作用形成的一种像干冰那样的包合物,“主人”物质即水通过氢键形成一个像笼子那样的结构,将一种“客人”物质即小疏水分子以物理方式截留。笼状水合物代表水对一种非极性物质最大的结构形成响应,类似的微结构也天然得存在于生物物质中。
疏水相互作用对大多数蛋白质的结构和性质非常关键。疏水相互作用为蛋白质的折叠提供了主要的推动力,使疏水残基处在蛋白质分子的内部。有趣的是,尽管蛋白质因疏水相互作用而使大部分疏水基相互聚集,仍有约1/3的疏水基暴露在水中,于是水在疏水面上的特殊结构存在于蛋白质的水化结构中。降低温度使疏水相互作用变弱而氢键变强。
疏水相互作用的作用长度可以达到大约100纳米,然而其他的分子作用力最多只有5纳米左右。然而关于疏水相互作用如此长的作用距离方面的研究,至今科学家们仍然没有得出令人满意的结论。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。