-
极化作用 编辑
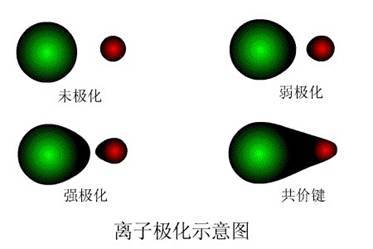
离子使异号离子极化而变形的作用称为该离子的“极化作用”;被异号离子极化而发生离子电子云变形的性能称为该离子的“变形性”。
中文名:极化作用
外文名:polarisation(英)/polarization(美)
电荷:阳离子电荷越高,极化力越强
半径:阳离子外壳相似电荷相等,半径小
引起:相互极化和附加极化作用
极化是指在最大辐射方向上辐射电波的极化,其定义为在最大辐射方向上电场矢量端点运动的轨迹,由于天线本身物理结构等原因,天线辐射远场的电场矢量除了有所需要方向的运动外,还在其正交方向上存在分量,这就指的天线的交叉极化。一般交叉极化要求在主方向上辐射的交叉极化增益要小于主极化增益30dB以上,当然不同场合其要求会有变化。至于微带天线如何降低交叉极化,没注意过,不过印象里好像选择h较低的基片(降低表面波的激励)要好些,或者用缝隙耦合底馈的方式也行。
离子使异号离子极化而变形的作用称为该离子的“极化作用”;被异号离子极化而发生离子电子云变形的性能称为该离子的“变形性”。
电子极化:在外电场作用下,电子云相对原子核发生微小位移,使电中性的原子形成一个很小的电偶极子。
离子极化:在外电场作用下,构成分子的正负离子发生微小位移,使分子形成一个很小的电偶极子。
取向极化:在外电场作用下,原来无序排列的有极分子转为有序排列,形成合成电矩。
一般单原子介质只有电子极化,所有化合物都存在电子极化和离子极化,某些化合物分子具有固有电矩并同时具有其他三种极化。
在电场(外电场或离子本身电荷产生的)作用下,离子的电子云发生变化,产生偶极或使原来偶极增大,这种现象叫做离子的极化。离子间除有静电引力作用外,还有其他的作用力。阳离子一般半径较小,又带正电荷,它对相邻阴离子会起诱导作用而使它变形(极化作用)。阴离子一般半径较大,外围有较多负电荷,因而在电场作用下容易发生电子云变形(离子的变形性)。实际上,每个离子都有使相反离子变形的极化作用和本身被其他离子作用而发生变形的变形性双重性质。电荷数大、半径小的阳离子有较强的极化作用。具有18电子层和不规则电子层的离子,它们的变形性比半径相近的惰气型离子大得多。例如,Ag+>K+;Hg2+>Ca2+。4.结构相同的离子,正电荷越多的阳离子变形性越小,电子层数越多的变形性越大。体积大的阴离子和18电子层或不规则电子层的少电荷阳离子(如Ag+、pb2+、Hg2+)最容易变形。最不容易变形的是半径小、电荷高的惰气型阳离子(如Be2+、Al3+、Si4+等)。离子极化对化学键有影响。阳、阴离子相互极化,使它们之间发生额外的吸引力。所以当两个离子更*近时,有可能使两个离子的电子云互相重叠起来,趋向于生成极性较小的共价型键。键型的变化,必将影响化合物的性质。一般随极化程度的增强,物质的熔点、沸点降低,颜色逐次加深,在水中的溶解性减小。
离子极化理论是离子键理论的重要补充。离子极化理论认为:离子化合物中除了起主要作用的静电引力之外,诱导力起着很重要的作用。离子本身带电荷,阴、阳离子接近时,在相反电场的影响下,电子云变形,正、负电荷重心不再重合,产生诱导偶极,导致离子极化,致使物质在结构和性质上发生相应的变化。
(1)结构相同的阳离子,正电荷量越高,变形性小,(Na+)>(Mg2+)>(Al3+)>(Si4+)
(2)对于外壳结构相同的离子,电子层数越多,变形性越大Li+<Na+<K+<Rb+<Cs+;F-<Cl-<Br-<I-
(3)电荷和半径相近时;18e-,18+2e-;9~17e->>8e-变形性:Ag+>K+;Hg2+>Ca2+等
(4)对于相同或类似的结构的离子,半径越大,变形性越大
(5)复杂阴离子变形性通常不大,中心离子氧化数越高,变形性越小ClO4-<F-<NO3-<CN-<Cl-<Br-<I-小结:最易变形是体积大阴离子和18e-,18+2e-,9~17e-的少电荷阳离子,如:Ag+、Pb2+、Hg2+等; 最不易变形是小半径高电荷稀有气体外壳阳离子,如Be2+、Al3+、Si4+等4、相互极化(附加极化)作用实际上,每一个离子一方面作为带电体,会使其他异号离子发生变形,另一方面,在周围离子作用下,本身也会产生变形,这种阴阳离子相互极化作用结果,使产生的诱导偶极矩加大,从而进一步加强了它们相互作用,这就是附加极化作用。显然,每个离子的总极化作用应是它原有极化作用与附加极化作用之和。
(1)电荷:阳离子电荷越高,极化力越强。
(2)半径:阳离子外壳相似电荷相等时,半径小,极化力强。如Li+>Na+。
(3)离子构型(阳离子):18e-,2e-,18+2e-,(Ag+、Li+、Pb2+等)>9~17e-(Fe2+、Ni2+、Cr3+)>8e-(Na+、Mg2+等) 。
(4)电荷高的复杂阴离子也具有一定极化作用,如SO42-、PO43-等。
相互极化作用的一些规律:
(1)18与(18+2)电子构型的正离子容易变形,容易引起相互极化和附加极化作用;
(2)在周期系的同族中,自上而下,18电子构型的离子附加极化作用递增,加强了这种离子同负离子的总极化作用;
(3)在具有18或(18+2)电子构型的正离子化合物中,负离子的变形性越大,附加极化作用越强。
总之,正离子所含有的d电子数越多,电子层数越多,这种附加极化作用一般也越大。
(1)晶体类型转变:离子晶体→分子晶体; 如AgF→AgI;NaF→SiF4→PCl5
(2)键型转变:离子型→共价型
(3)结构转变:共价性增强,配位数减小。如AgF(NaCl型)→AgI(ZnS型)
(4)熔、沸点变化:降低
(5)溶解性变化:减小
(6)颜色变化:颜色加深
(1)MgO的熔点高于Mn2O7;
(2)AgCl,AgBr,AgI颜色依次加深;
(3)HgS在水中溶解度很小。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。