-
反应方向 编辑
化学反应的自发性方向(简称为“反应方向”),即在一定条件下,无需借助于外力,反应自动进行的方向。自然界发生的过程都有一定的方向性。例如,水总是自动从高处向低处流,而不会自动进行反方向的流动。又如,当两个温度不同的物体互相接触时,热会自动地从温度高的物体传向温度低的物体,直到两个物体的温度相等为止。就化学变化来看,如果把锌片置于稀硫酸中,锌片会自动溶解并有氢气生成。这些不需要外力作用,便可自发进行的过程称为自发过程(化学过程称为自发反应)
中文名:反应方向
外文名:reaction direction
概述:化学反应的自发性方向
定义:反应进行的方向
影响因素:焓变和熵变
反应方向(reaction direction)是指反应物和生成物均处于标准态时反应进行的方向。
焓变
化学反应中所吸收或放出的能量有多种形式:热能、光能、声能和电能等。其中所吸收或放出的热量称为反应热(或热效应)。众所周知,反应热不仅与反应物的组成、结构、和性质有关,而且与其状态和用量,以及反应条件(如温度和压力等)有关,热力学上将反应前后温度和压力都不变的反应称为恒温恒压反应。例如,人体内进行的一系列反应,基本上是恒温恒压反应。恒压反应的反应热在数值上等于反应焓变。
对于反应焓变,可作如下理解:反应的吸热或放热表明,反应物和产物各自有不同的“焓”(H),当反应物的焓比产物的焓高(多)时,由反应物变成产物,就要释放出那多余的部分。则反应焓变(△H)为:
△H=H终态—H始态=H产物—H反应物
若H产物<H反应物,则 △H<0,即为放热反应
若H产物>H反应物,则 △H>0,即为吸热反应
例如,下列两个反应,若进行恒温恒压反应(T=298.15 K,p=101. 325kPa),各自的焓变为(g表示气态)。
N2(g)+8H2(g)→2NH3(g)
△H=―=-92.38kj/mol
N2(g)+2O2(g)→2NO2(g)
△H=―=+67.70kj/mol
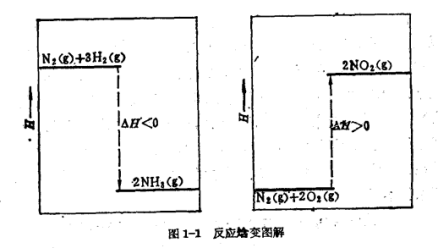 反应焓变
反应焓变
许多化学反应都是向着能量降低的方向进行。而放热是系统能量降低的一种方式,即放热有利于反应的自发进行。所以起初有人提出用焓变做为判断反应方向的依据,即△H<o的反应能自发进行。然而,冰的溶化,KNO。溶于水都是吸热过程,在常温下却能自发进行。而CaCO3。的分解也是吸热反应,在常温下不能自发进行,而高温时,却能自发进行了。可见只用焓变作为反应自发性的判据是不够的。
熵变
混乱度是指系统内质点混乱的程度,即组成物质的质点在指定空间内排列和运动的无序程度。系统的混乱度越高即有序度越差。大量的实验证明,在孤立系统中,自发过程总是混乱度增加的过程。
例如,硝酸铵等盐类的溶解。晶体NH4NO3中正、负离子整齐而有序地排列,到它进入水中时,正、负离子向水中扩散而自由运动,而水分子同时也扩散到正、负离子间,最终成为均匀的溶液。和溶解前相比i溶液的温度降低(吸热过程),同时溶液中粒子的运动状态要比溶质和纯溶剂中更为混乱。
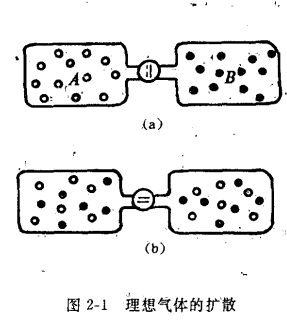 理想气体的扩散
理想气体的扩散
在上述两个例‘中,第一例的溶解过程,既有能量交换因素(吸热或放热),又有混乱增加的因素。第二例中自发过程是向混乱度增加的方向进行。
总之,可见影响物理、化学过程自发性的因素有两个,一是能量因素,另’一个则是体系的混乱度变化因素。任何自发过程都倾向于:a降低体系的能量;b.增加体系的混乱度。
体系中微观粒子的任何微观性质,都必然表现为体系一定的宏观性质。正如体系中粒子平均动能的总表现为体系的温度一样,体系混乱度的宏观量度称熵,用符号s表示。体系的混乱度小或处在较有秩序的状态,其熵值小;混乱度大或状态较无秩序,对应的熵值就大。
体系的状态一定,其混乱度的大小就一定,相应地,必有一个确定的熵值。因此,熵也是体系的一个状态函数,是反映体系中粒子运动的混乱程度的一个物理量。
根据上述熵的物理意义,可得出如下结论:
a.对同一物质而言,气态时的熵值要比液态时大,液态的熵值又大于固‘态,因为从固态到液态再到气态,粒子运动的混乱度依次增加,熵值必然依次增大,即
S气>S液>S固
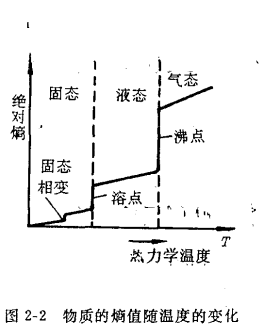 物质的熵值随温度变化图
物质的熵值随温度变化图
体系的混乱度增大,熵值也将增大。如上图所示,即S高温>S低温
c.压力降低时,气体体积增大,粒子在较太的空间运动,
其混乱度必增大,所以低压气体的熵值要比高压气体的大,即
S低气压>S高气压
d·不同物质的熵值不同,与其分子的组成和结构有关。一般而言,
分子越大,结构越复杂,其运动情况也越复杂,混乱度就越大,
熵值也越大。
吉布斯能
 吉布斯能
吉布斯能
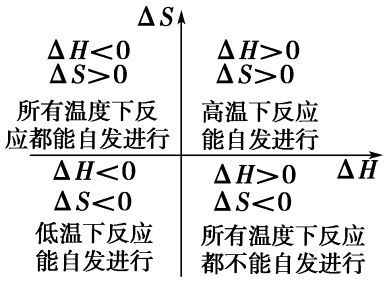
为了确定一个过程(或反应)自发性的判据,美国著名物理化学家吉布斯(J.w.Gibbs)综合考虑了系统的H、S以及温度这三者之间的关系,提出了一个新的状态函数,称为吉布斯自由能,用G表示。G=H-TS
△G
△G=△H-T△S称为吉布斯公式
吉布斯提出:在恒温、恒压条件下,A,G。可作为反应(过程)自发性的判断。即
△G<0, 自发过程
△G=o, 平衡状态
△G>0, 非自发过程
恒温、恒压下,任何自发过程总是朝着吉布斯自由能(G)减小的方向进行。△rGm=0时,反应达平衡,体系的G降低到最小值。此即为著名的最小自由能原理。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。






























