-
铑 编辑
铑(Rhodium),元素周期表第五周期第9族过渡金属,属铂系元素。元素符号为Rh,原子序数45,相对原子质量102.9055。极硬的银白色金属,立方晶系。相对密度为12.41g/cm3(20℃) ,熔点1966℃±3℃,沸点3727℃±3℃。电阻率4.51×10-8Ω·m(20℃)。铑具有化学惰性,在空气、卤素、水和稀酸中稳定,微溶于王水,溶于熔融碱和硫酸氢钾中。主要氧化态是+1和+3。 可从精炼镍的废料中提取。
铑是一种稀有的贵金属材料,主要以铑催化剂、铑合金、铑镀层、铑化合物应用于化学、石油、玻璃、电气、牙科、饰品、汽车等领域。 铑和铂组成的铂铑合金是一种重要的合金材料,具有很强的抗氧化能力、耐酸腐蚀能力以及抗电弧烧损能力。铂铑合金可以用作测量温度的热电偶材料,也可以制造电气接点和火花塞电极等。
铑的商业应用价值很有限,主要用作铂的硬化添加剂及某些反应的催化剂。在美国,铑用于机动车尾气催化转化器。机动车内燃机中产生的废气含有一氧化碳、二氧化氮和各种未燃烧的碳水化合物,这些物质都是大气污染的重要来源。机动车催化转化器中装有含铂、钯、铑的小微粒,能把通过它们的热的废气转化成无害物质,一氧化碳和未燃烧的碳水化合物被转化成二氧化碳和水,二氧化氮转化成氮和氧。铑在机动车上的另一用途是用于制造前灯的反射罩。
中文名:铑
外文名:Rhodium
化学式:Rh
CAS登录号:7440-16-6
EINECS登录号:233-397-6
熔点:1966 ℃
沸点:3727 ℃
水溶性:不溶
密度:12.41 g/cm³
外观:银白色金属
应用:制造合金、镀膜
安全性描述:S16;S17;S22;S24/25;S26;S36/37/38;S45
危险性符号:F;Xi
危险性描述:R11
UN危险货物编号:3089
原子量:102.906
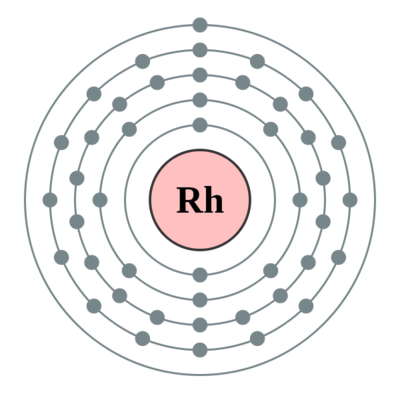
原子序数:45
外围电子排布:4d85s1
1803年,英国人武拉斯顿William Wollaston和史密森·坦南特Smithson Tennant在一个商业投资中合作,多半是为了生产出纯铂来出售。这个流程的第一步是在王水(硝酸+盐酸)中溶解普通的铂。但不是所有的都溶入了溶液中,还留下了黑色的残渣,Tennant研究了残渣,最终从中提取出了锇和铱。Wollaston则全神贯注于这个溶解的铂溶液,用沉淀法移除其他金属,留下了一种红色溶液,并从中获得了玫瑰红晶体,这些就是氯铑酸钠。最终Wollaston从中生产出了这种金属自身的样本。因这种新金属的盐溶液具有玫瑰的艳红色,所以以希腊文中的玫瑰“rhodon”命名它为rhodium,元素符号为Rh。
物理性质
 金属铑
金属铑
铑具有光亮银白色的外观,具有较高的反射能力,反射系数在72%-75%之间,仅次于金属银。
相对原子质量 | 102.9055 |
|---|---|
密度 | 12.41g/cm3 |
熔点 | 1966℃±3℃ |
沸点 | 3727℃±3℃ |
元素类别 | 过渡金属 |
性质 | 常温下为银白色金属 |
化学性质
 一根铑丝
一根铑丝
在铑的多种氧化态中,I和III是最重要的氧化态,其它氧化态则较为少见。+III氧化态的铑最为常见,黄色3+中的铑就是正3价的。Rh的络合物,特别是与含氮配体生成的络合物,与Co(III)的相应络合物相似。Rh(I)存在于配体为π接受体的络合物中。Rh(I)的络合物多数是配位数为4的平面正方形,但也有一些配位数为5的Rh(I)络合物。
铑的化学性质十分稳定,在室温条件下耐酸碱,对硫化物稳定。除海绵状铑外,其它形态的铑不溶于王水。 铑镀层光亮、耐变色、硬而耐磨、接触电阻小,但不能钎焊,在高温条件下容易氧化。
铑与空气的反应
铑在空气中几乎不会被腐蚀,在空气中把铑加热到600℃时,会生成氧化铑(Ⅲ)(Rh2O3)。
一般来说,第二和第三过渡系的相应元素的化学性质会比较接近。但是这一列元素中,在周期表中紧靠在铑下面的铱会在空气中氧化,生成氧化铱(Ⅳ)(IrO2)。%20
铑与其他氧族元素(硫硒碲)的反应
铑与相应的单质混合后共同加热,即可制得灰黑色RhS2固体、灰黑色RhSe2固体或灰黑色RhTe2固体,RhCl3与硫共热,可制得灰黑色三硫化二铑Rh2S3固体。此化合物很不活泼,与强酸都不发生反应。%20
铑与卤素单质的反应
金属铑可以直接同氟气发生反应,并生成具有强腐蚀性的六氟化铑(Ⅵ)(RhF6)。小心加热这种物质,可以生成暗红色的四聚氟化铑(Ⅴ)4。%20
用金属铑和卤素单质在无水条件下发生直接反应,可以生成相应的三氟化铑(Ⅲ)(RhF3)、三氯化铑(Ⅲ)(RhCl3)和三溴化铑(Ⅲ)(RhBr3)。%20
用碘化钾KI与RhBr3·2H2O作用,生成黑色三碘化铑RhI3固体。%20
铑和酸的反应
王水是盐酸和硝酸的混合物,可以溶解金。但金属铑几乎不与包括王水在内的酸发生反应。%20
制备铑首先需要对矿石或生产贱金属后的副产品进行预处理,以除去银、金、钯和铂。然后把残渣与硫酸氢钠(NaHSO4)共熔,再用水浸泡所得到的混合物,这样就得到了含有硫酸铑Rh2(SO4)3的溶液。向溶液中加入氢氧化钠,使铑以氢氧化物的形式沉淀下来。用盐酸溶解铑的氢氧化物,生成H3RhCl6,再用亚硝酸钠和氯化铵处理溶液,使铑以配合物(NH4)3的形式沉淀下来。用盐酸处理沉淀,可以得到纯净的氯铑酸铵(NH4)3RhCl6的溶液。最后蒸干并在氢气中燃烧沉淀,就可以得到纯净的金属铑。
工业用途
铑主要以铑催化剂、铑合金、铑镀层、铑化合物应用于化学、石油、玻璃、电气、牙科、饰品、汽车等领域。1992年西方国家共消费铑10.2吨,其中汽车废气净化催化剂用量达86%。
除了制造合金外,铑可用作其他金属的光亮而坚硬的镀膜,例如,镀在银器或照相机零件上。将铑蒸发至玻璃表面上,形成一层薄蜡,便造成一种特别优良的反射镜面。
铑与铂(Pt)的合金还可作为高品质玻璃熔炼的容器使用。含10%-13%(质量分数)Rh的Pt合金与纯Pt组成的Pt-Rh热电偶可用于1600℃以下的温度测量。在两种不同导电材料构成的闭合回路中,当两个接点的温度不同时,回路中会产生电势而产生热电流(塞贝克效应)。如果一端温度已知(如0℃),测得电动势即可知道另一端的温度。这就称为热电偶。
医疗用途
 铑粉
铑粉
铑的配合物只对有限的几种肿瘤有抗癌活性。Mer-具有与顺铂相似的顺式氯配体,因而首先被用于抗肿瘤实验,结果表明只对Sarcomal80有稳定抑制作用。摄影是诊断乳腺疾病的检查方法之一,尽管B超、CT、MRI技术发展很快,但乳腺钼、铑双靶X射线摄影技术,是乳腺肿瘤检查尤其是诊断早期乳腺癌最有效的方法。
 含有金属铑的废品
含有金属铑的废品
世界铂族资源总储量为6.97万吨,其中南非储量6.3万吨,俄罗斯0.39万吨,津巴布韦0.12万吨,美国0.09万吨,中国0.04万吨,加拿大0.031万吨。
中国铂族金属资源比较稀缺,铂族金属矿床分布在10个省、自治区,甘肃、云南、四川和黑龙江的储量较多,这四省的储量占全国储量的94.6%。其他省区如河北、青海、新疆、北京、内蒙古也有一些小矿点,但储量很少。
环境危害
对水有稍微的危害,切勿让未稀释和大量的产品接触地下水、下水道或者污水系统。
危害防治
如大量吸入,立即移离现场至新鲜空气处,必要时,及时进行人工呼吸;如被吞服,给予医学注视,诱致呕吐,洗胃,并送医院治疗。
储存运输
加入紧封的储存器内,储存在阴凉、干燥的地方。确保工作间有良好的通风排气装置。
避免接触湿气和水源,远离火源。避免接触酸性物质,氧化剂接触。
在空气中的测定:用滤材采样,酸处理,原子吸收法测定。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。