-
氯 编辑
氯(Chlorine)是一种非金属元素,元素符号Cl,原子序数为17,位于第三周期,VII A族,是卤族元素之一。氯单质由两个氯原子构成,化学式为Cl2。气态氯单质称为氯气,液态氯单质称为液氯。氯气常温常压下为黄绿色气体,有强烈的刺激性气味,化学性质十分活泼,具有毒性。氯以化合态的形式广泛存在于自然界当中,对人体的生理活动也有重要意义。
中文名:氯
外文名:Chlorine
外观:黄绿色气体(氯气)
发现者:卡尔·威尔海姆·舍勒
元素类型:活泼非金属单质
原子序数:17
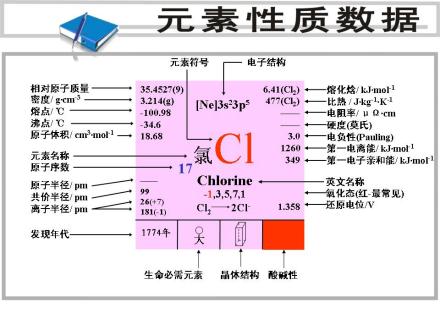
原子量:35.45
元素符号:Cl
周期:第三周期
族:VII A族
区:p区
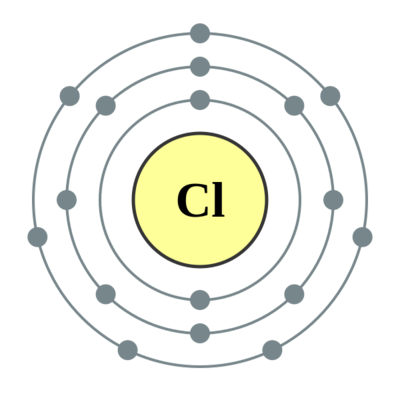
电子排布:3s23p5
电负性:3.16(鲍林标度)
 元素性质数据
元素性质数据
有机氯化合物。
Ag++Cl-→AgCl↓
严加密闭,提供充分的局部排风和全面通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴空气呼吸器,穿带面罩式胶布防毒衣,戴橡胶手套。远离火种、热源,工作场所严禁吸烟。远离易燃、可燃物。防止气体泄漏到工作场所空气中。避免与醇类接触。搬运时轻装轻卸,防止钢瓶及附件破损。配备相应品种和数量的消防器材及泄漏应急处理设备。
2、储存注意事项
储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃,相对湿度不超过80%。应与易燃物(可燃物)、醇类、食用化学品分开存放,切忌混储。储区应备有泄漏应急处理设备。应严格执行极毒物品“五双”管理制度。
 集气瓶中的氯气
集气瓶中的氯气
氯气分子由两个氯原子组成,微溶于水,易溶于碱液,易溶于四氯化碳、二硫化碳等有机溶剂。
氯有26种同位素,其中只有35Cl和37Cl是稳定的,其余同位素均具有放射性。
原子半径:100 pm
核外电子排布:3s23p5
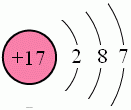 氯原子结构示意图
氯原子结构示意图
晶体结构:斜方晶系
电负性:3.16(鲍林标度)
第一电离能:1251.2 kJ/mol
参与光合作用
在光合作用中,氯作为锰的辅助因子参与水的光解反应。水光解反应是光合作用最初的光化学反应,氯的作用位点在光系统II。研究工作表明,在缺氯条件下,植物细胞的增殖速度降低,叶面积减少,生长量明显下降(大约60%),但氯并不影响植物体中光合速率。由此可见,氯对水光解放O2反应的影响不是直接作用,氯可能是锰的配合基,有助于稳定锰离子,使之处于较高的氧化状态。氯不仅为希尔反应放O2所必需,它还能促进光合磷酸化作用。
调节气孔运动
氯对气孔的开张和关闭有调节作用。当某些植物叶片气孔开张时,K+流入是由有机酸阴离子(主要是苹果酸根)作为陪伴离子,这些离子在代谢过程中是靠消耗淀粉产生的;但是对某些淀粉含量不多的作物(如洋葱),当K+流入保卫细胞时,由于缺少苹果酸根则需由Cl-作为陪伴离子。缺氯时,洋葱的气孔就不能自如地开关,而导致水分过多地损失。由于氯在维持细胞膨压、调节气孔运动方面的明显作用,从而能增强植物的抗旱能力。
激活H+-泵ATP酶
以往人们了解较多的是原生质上的H+-ATP酶,它受K+的激活。而在液泡膜上也存在有H+-ATP酶。与原生质上的H+-ATP酶不同,这种酶不受一价阳离子的影响,而专靠氯化物激活。该酶可以把原生质中的H+转运到液泡内,使液泡膜内外产生pH梯度(胞液,pH>7;液泡,pH<<6)。缺氯时,植物根的伸长严重受阻,这可能和氯的上述功能有关。因为缺氯时,影响活性溶质渗入液泡内,从而使根的伸长受到抑制(Hagerh和Helrnle,1981)。
抑制病害发生
施用含氯肥料对抑制病害的发生有明显作用。据报道,2013以前年至少有10种作物的15个品种,其叶、根病害可通过增施含氯肥料而明显减轻。例如冬小麦的全蚀病、条锈病,春小麦的叶锈病、枯斑病,大麦的根腐病,玉米的茎枯病,马铃薯的空心病、褐心病等。根据研究者的推论,氯能抑制土壤中铵态氮的硝化作用。当施入铵态氮肥时,氯使大多数铵态氮不能被转化,而迫使作物吸收更多的铵态氮;在作物吸收铵态氮肥的同时,根系释放出H+离子,使根际酸度增加。许多土壤微生物由于适宜在酸度较大的环境中大量繁衍,从而抑制了病菌的滋生,如小麦因施用含氯肥料而减轻了全蚀病病害的发生。还有一些研究者从Cl-和NO3-存在吸收上的竞争性来解释。施含氯肥料可降低作物体内NO3-的浓度,一般认为NO3-含量低的作物很少发生严重的根腐病。
其他作用
在许多阴离子中,Cl-是生物化学性质最稳定的离子,它能与阳离子保持电荷平衡,维持细胞内的渗透压。植物体内氯的流动性很强,输送速度较快,能迅速进入细胞内,提高细胞的渗透压和膨压。渗透压的提高可增强细胞吸水,并提高植物细胞和组织束缚水分的能力。这就有利于促进植物从外界吸收更多的水分。在干旱条件下,也能减少植物丢失水分。提高膨压后可使叶片直立,延长功能期。作物缺氯时,叶片往往失去膨压而萎蔫。氯对细胞液缓冲体系也有一定的影响。氯在离子平衡方面的作用,可能有特殊的意义。
氯对酶活性也有影响。氯化物能激活利用谷氨酰胺为底物的天冬酰胺合成酶,促进天冬酰胺和谷氨酸的合成。氯在氮素代谢过程中有重要作用。
适量的氯有利于碳水化合物的合成和转化。
氯气遇水歧化为盐酸和次氯酸,次氯酸不稳定易分解放出游离氧,其中次氯酸具有漂白性(比SO2强且加热不恢复原色)。
氯气也能和很多有机物发生加成或取代反应,在生活中有广泛应用。
氯气具有较大的毒性,曾被用作军用毒气。
Cl-检验
检验水中是否含有氯离子可以向其中加入可溶的银离子(硝酸银)(加入酸性硝酸银可以排除其他离子干扰),银离子和氯离子反应会生成氯化银白色沉淀。再取白色沉淀,加入稀硝酸,沉淀不溶解,则说明含氯离子。
含氧酸
1.次氯酸(HClO)及其盐
(1)制备
①通氯气于冰水中:
②通氯于碱液中可得次氯酸盐:
③工业上用电解冷浓食盐水并剧烈搅拌来制备NaClO。
(2)性质
①是弱酸,但为很强的氧化剂,且具有漂白性
②受热易发生氧化还原反应:
(3)用途
制造漂白粉Ca(ClO)₂:
2.亚氯酸(HClO₂)及其盐
亚氯酸是唯一的亚卤酸,非常不稳定。
(1)制备
①ClO₂在水中分解:
②通ClO₂于Na₂O₂或NaOH与H₂O₂可得亚氯酸盐:
(2)性质与用途
①非常不稳定的化合物,但亚氯酸盐较稳定。
②具有漂白性%20
3.氯酸(HClO₃)及其盐
浓度高于40%则不稳定
(1)制备
次氯酸根水溶液加热,产生自身氧化还原反应(歧化反应):
(2)性质及用途
①氯酸和氯酸盐皆为强氧化剂。
②氯酸钾用于制造炸药。
③KClO₃受热反应:
a.
b.
4.高氯酸(HClO₄)及其盐
(1)制备
①低压蒸馏KClO₄与H₂SO₄的混合液:
②电解食盐水时,阳极产生的氯气被氧化:
③氯酸盐受热分解:
(2)性质与用途
①氯最稳定的含氧酸,不易分解
②非常强的酸(高中范围内最强的酸,强于100%硫酸,但弱于氟锑酸等超强酸)
工业
氯主要用于化学工业尤其是有机合成工业上,以生产塑料、合成橡胶、染料及其他化学制品或中间体,还用于漂白剂、消毒剂、合成药物等。氯气亦用作制造漂白粉、漂白纸浆和布匹、合成盐酸、制造氯化物、饮水消毒、合成塑料和农药等。提炼稀有金属等方面也需要许多氯气。
生理
氯是人体必需常量元素之一,是维持体液和电解质平衡中所必需的,也是胃液的一种必需成分。自然界中常以氯化物形式存在,最普通形式是食盐。氯在人体含量平均为1.17g/kg,总量约为82~100g,占体重的0.15%,广泛分布于全身。主要一氯离子形式与钠、钾化合存在。其中氯化钾主要在细胞内液,而氯化钠主要在细胞外液中。
膳食氯几乎完全来源于氯化钠,仅少量来自氯化钾。因此食盐及其加工食品酱油、腌制肉或烟熏食品、酱菜类以及咸味食品等都富含氯化物。一般天然食品中氯的含量差异较大;天然水中也几乎都含有氯。%20
主要生理功能:
1.维持体液酸碱平衡。
3.氯离子还参与胃液中胃酸形成,胃酸促进维生素B12和铁的吸收;激活唾液淀粉酶分解淀粉,促进食物消化;刺激肝脏功能,促使肝中代谢废物排出;氯还有稳定神经细胞膜电位的作用等。
氯气对环境有严重危害,对水体可造成污染。
同时,氯气可助燃,湿润的氯气具有强腐蚀性。
所以接触氯气时,需注意全身严格防护,严禁直接嗅闻、接触氯气,不得将含氯气的废气直接排放到大气中。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。