-
质子 编辑
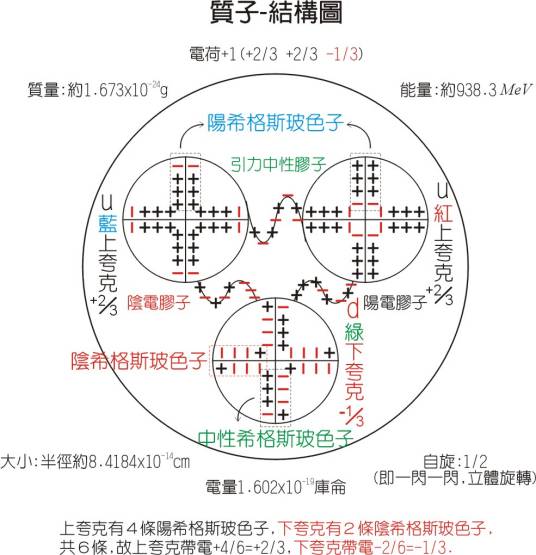
质子(proton)是一种带1.6 × 10-19库仑(C)正电荷的亚原子粒子,直径约1.6~1.7×10−15m,质量是938百万电子伏特/c²(MeV/c²),即1.672621637(83)×10-27千克,大约是电子质量的1836.5倍(电子的质量为9.10938215(45)×10-31千克),质子比中子稍轻(中子的质量为1.674927211(84)×10-27千克)。质子属于重子类,由两个上夸克和一个下夸克通过胶子在强相互作用下构成。原子核中质子数目决定其元素的种类和它属于何种化学元素。
中文名:质子
外文名:proton
所属粒子类型:复合粒子
所属学科:物理
发现时间:1918年
发现人:欧内斯特·卢瑟福
电荷:+1元电荷(+1.602176634 × 10-19库仑)
粒子自旋:1/2
粒子磁矩:2.7928单位核磁子
作用力:引力、电磁力、弱核力、强核力
半衰期:最短为1035年(可视为稳定)
组成:两个上夸克、一个下夸克
质子数=原子序数(就是元素序号)=核外电子数,中子数=质量数-质子数
1.氧元素是第二周期的元素,所以氧原子只有2个电子层内从层2个,外层6个,共8个电子;而氧原子的质子数也是8个。符合核外电子数=质子数,所以氧原子本身是电中性的,不带电荷。
事实上所有的原子都是电中性的,都符合【质子数】=【原子序数】=【核电荷数】=【核外电子数】
2.每种物质中的原子的核外电子数一定是等于该原子的质子数,但是这并不是说这种结构是稳定的结构,这只是元素原子的一个特性。比如Na原子就非常不稳定,很容易失去一个电子变成Na+,带一个正电荷,达到稳定结构。注意此时带电荷是因为变成了离子。对于未失去电子的Na原子来说,还是符合核外电子数=质子数
 百科x混知:图解粒子
百科x混知:图解粒子
 质子直线加速器
质子直线加速器
今时今日,以粒子物理学的标准模型理论为基础而论,因为质子是复合粒子,所以不再被编入基本粒子的家族中。
2024年3月25日,据欧洲核子研究中心(CERN)官网报道,该机构大型强子对撞机(LHC)上的紧凑缪子线圈(CMS)国际合作组宣布,他们利用CMS轨迹探测器出色的追踪能力,首次观察到质子对撞中两个光子“变身”为两个陶子(τ)。
卢瑟福把这种粒子引进电场和磁场中,根据它在电场和磁场中的偏转,测出了它的质量和电量,确定它就是氢原子核,又叫做质子,通常用符号1H或p表示。
这个质子是α粒子直接从氮核中打出的,还是α粒子打进复核后形成的复核发生衰变时放出的呢?为了弄清这个问题,英国物理学家布拉凯特又在充氮的云室里做了这个实验。如果质子是α粒子直接从氮核中打出的,那么在云室里就会看到四条径迹:放射α粒子的径迹、碰撞后散射的。粒子的径迹、质子的径迹及抛出质子后的核的反冲径迹.如果粒子打进氮核后形成一个复核,这复核立即发生衰变放出一个质子,那么在云室里就能看到三条径迹:入射α粒子的径迹、质子的径迹及反冲核的径迹。布拉凯特拍摄了两万多张云室照片,终于从四十多万条“粒子径迹的照片中,发现有八条产生了分叉。分叉的情况表明,这第二种设想是正确的。从质量数守恒和电荷数守恒可以知道产生的新核是氧17。
在云室的照片中,分叉后细而长的是质子的径迹,短而粗的是反冲氧核的径迹。
后来,人们用同样的方法使氟、钠、铝等核发生了类似的转变,并且都产生了质子。由于各种核里都能轰击出质子,可见质子是原子核的组成部分。
水中的氢离子绝大多数都是水合质子。质子在化学和生物化学中起非常大的作用,根据酸碱质子理论,可以在水溶液中提供质子的物质一般被称为酸,可以在水溶液中吸收质子的物质一般被称为碱。
然而,质子是通过中子的过程中电子捕获。这一过程不会自发发生,但只有当能源供应。其计算公式:
于此
p是一个质子,
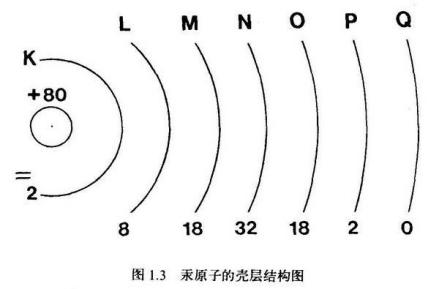 汞原子的壳层结构图
汞原子的壳层结构图
n是一个中子,而且
νe是一个电子中微子
这个过程是可逆的:中子可转换回质子通过β-衰变,共同形成放射性衰变。事实上,在一个自由中子衰变这样一个平均寿命约15分钟。
 质子磁力仪
质子磁力仪
 核武器原子弹
核武器原子弹
符号p,H+
发现时间1919年
发现者欧内斯特·卢瑟福
由于阿累尼乌斯的酸碱离子理论不能解一些非水溶液中进行地酸碱反应等问题,1923年布朗特(Bronsted)提出了酸碱质子理论,把酸碱概念加以推广。酸碱质子理论认为凡是能给出质子的物质都是酸,凡是能与质子结合的物质都是碱。即酸是质子的给予体,碱是质子的接受体。这样,一个酸给出质子后余下的部分自然就是碱,因为它本身就是与质子结合的。
这种关系叫做酸碱的共轭关系,式中略去了HB和B可能出现的电荷。右边的碱是左边酸的共轭碱,左边的酸是右边碱的共轭酸,两者组成一个共轭酸碱对,它们只直差一个质子。从以上例子可以看出,酸和碱可以是分子,也可以是阳离子和阴离子。还可以看出,像HPO2-4这样的物质,既表现酸,也
 质子磁力仪
质子磁力仪
根据酸碱质子理论,酸碱在溶液中所表现出来的强度,不仅与酸碱的本性有关,也与溶剂的本性有关。我们所能测定的是酸碱在一定溶剂中表现出来的相对强度。同一种酸或碱,如果溶于不同的溶剂,它们所表现的相对强度就不同。例如HOAc在水中表现为弱酸,但在液氨中表现为强酸,这是因为液氨夺取质子的能力(即碱性)比水要强得多。这种现象进一步说明了酸碱强度的相对性。
三、酸碱反应酸碱质子理论中的酸碱反应是酸碱之间的质子传递。例如:这个反应无论在水溶液中、苯或气相中,它的实质都是一样的。HCl是酸,放出质子给NH3,然后转变成共轭碱Cl-,NH3是碱,接受质子后转变成共轭酸NH4+。强碱夺取了强酸放出的质子,转化为较弱的共轭酸和共轭碱。酸碱质子理论不仅扩大了酸碱的范围,还可以把酸碱离解作用、中和反应、水解反应等,都看作是质子传递的酸碱反应。由此可见,酸碱质子理论更好地解释了酸碱反应,摆脱了酸碱必须在水中才能发生反应的局限性,解决了一些非水溶剂或气体间的酸碱反应,并把水溶液中进行的某些离子反应系统地归纳为质子传递的酸碱反应,加深了人们对酸碱和酸碱反应的认识。但是酸碱质子理论不能解释那些不交换质子而又具有酸碱性的物质,因此它还存在着一定的局限性。
路易斯提出的酸碱电子理论是目前概括最广的酸碱理论。该理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。即酸是电子对的接受体,碱是电子对的给予体。因此,碱中给出电子的原子至少有一对孤对电子(未成键的电子对),而酸中接受电子的原子至少有一个空轨道(外层未填充电子的轨道),以便接受碱给予的电子对,这种由路易斯定义的酸和碱叫做路易斯酸和路易斯碱。例如,三氟化硼(BF3)是路易斯酸,因为BF3中的B原子有一个空轨道是电子的接受体。NH3中N原子有一对孤对电子,是电子对的给予体,为路易斯碱。但是,由于酸碱电子理论概括的酸碱范围太宽,使其实用价值受到一定的限制。
方法一:两式相减得C(H+)+C(H2CO3)=C(CO32-)+C(OH-)这个式子叫质子守恒。方法二:由酸碱质子理论原始物种:HCO3-,H2O消耗质子产物H2CO3,产生质子产物CO32-,OH-C(H+)=C(CO32-)+C(OH-)-C(H2CO3)即C(H+)+C(H2CO3)=C(CO32-)+C(OH-)关系:剩余的质子数目等于产生质子的产物数目-消耗质子的产物数目直接用酸碱质子理论求质子平衡关系比较简单,但要细心;如果用电荷守恒和物料守恒关系联立得到则比较麻烦,但比较保险,又如NaH2PO4溶液,原始物种:H2PO4-,H2O,消耗质子产物:H3PO4,产生质子产物:HPO42-(产生一个质子),PO43-(产生二个质子),OH-,所以:c(H+)=c(HPO42-)+2c(PO43-)+c(OH-)-c(H3PO4)可以用电荷守恒和物料守恒联立验证下。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。