-
原子模型 编辑
原子模型是人们对物质世界微观结构的认识而建立的模型。人们普遍接受的原子模型为由原子核(质子和中子)和电子构成,电子绕核做不规则运动,形成的电子云模型。原子模型最早由英国科学家道尔顿(Dalton)在1803年提出,经过汤姆逊(Thomson)、卢瑟福(Rutherford)、波尔(Bohr)等人的改进与完善,进而形成了近代原子模型。
 原子模型。图源网络
原子模型。图源网络
道尔顿原子模型
随着经验知识的积累,随着对客观世界认识的不断深入,道尔顿(Dalton,英国)于1803年提出的原子学说与古老的原子论有本质的区别,道尔顿原子学说的要点如下:
(1)原子是最小的、不能再分割的实心球体,同种元素的原子是相同的,如体积、质量以及化学性质等,但不同元素的原子是不同的;
(2)化合物是由两种或两种以上元素的原子组成的,在化合物中,任意两种元素的原子数之比不是一个整数就是一个简单的分数;
(3)化学反应就是不同原子的分离、结合成重新组合,而没有原子的创生或消失。
道尔原子学说不仅能够充分解释已有的化学基本定律(如质量守恒定律、当量定律等),面且能与实验事实相互印证,从而使该学说去掉了哲学面纱,真正成为一种科学理念,道尔顿原子学说的建立,标志着人类对物质结构的认识前进了一大步,为物理学、化学和生物学的发展奠定了重要的理论基础,特别是打开了化学学科汹涌澎湃、迅速发展的闸门,但另一方面,由于当时科学水平和实验条件的限制,原子不可分割的思想在较长一段时间阻碍了物质结构理论的进一步发展。
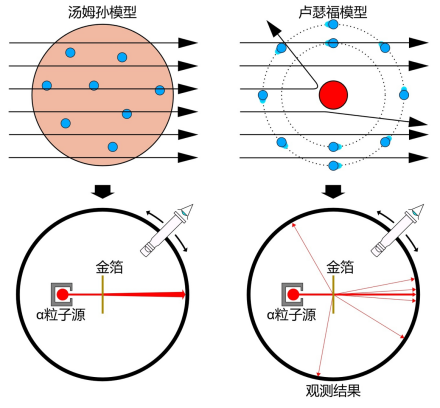
汤姆孙原子模型
 图1
图1
卢瑟福的含核原模型
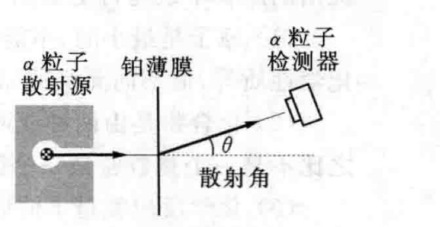 图2
图2
玻尔原子模型
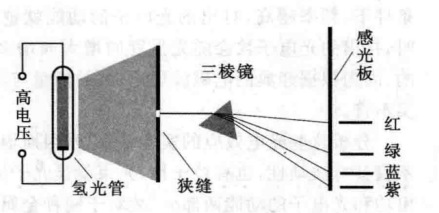 图3
图3
根据经典的电磁理论,电子绕原子核高度旋转时必然会发射电磁波,与此同时电子的能量会逐渐减小,最终电子会落到原子核上,这时原子就毁灭了,用经典电磁理论分析得到的这种结论显然与事实不符,其根本原因在于卢瑟福的含核原子模型仍有不足之处,为了说明氢原子光谱的实验结果,玻尔(Bohr,丹麦)于1913年结合已有的实验结果,并引用普朗克的量子理论即徽观粒子不能以连续的电磁波形式吸收或发射能量,而只能不连续地,一份一份地吸收或发射能量,提出了玻尔原子模型,玻尔原子模型要点如下:
(1)核外电子只能在一些特定的具有一定能量的圆形轨道上运动,这种运动不吸收也不放出能量,即在电子运动过程中原子的能量不变。把这种运动状态叫做定态(stationarystate),在不同轨道上运动的电子就处于不同的定态。
(2)当电子在离核最近的轨道上运动时电子的能量最低,把这种定态称为基态(groundstate),通常各原子都处于基态,当外界供给能量时,处于基态的电子就有可能吸收能量而被激发跳跃到离核较远的、能量较高的轨道上运动,把这种能量较高的定态叫做激发态(excited state)。
(3)当电子在不同定态之间跃迁时,会随能量的吸收或放出。如果是以电磁波的形式吸收或放出能量,则电磁波的频率v与两个定态间的能量差△E的关系如下:
ΔE=|
其中,h=6.626×10-34J▪s,h为普朗克常数。
由于不同定态(亦即不同能级)的能量E1、E2,…是分立的、不连续的,所以吸收或发射光谱的频率(或者波长)也是分立的、不连续的,其光谱是线状光谱。
虽然用玻尔原子模型可以说明简单的氢原子光谱,但这只是其成功的一面。实际上,用分辨率很高的仪器时,上述图3所示的每一条氢原子谱线都是由波长很接近的几条谱线组成的,用玻尔原子模型无法说明这种氢原子光谱的精细结构,也不能说明多电子原子光谱,这说明玻尔原子模型也有它的不足之处。尽管如比,玻尔理论第一次把光谱实验事实纳人了一个理论体系中,在含核原子模型的基上提出一种动态的原子结构轮席。该理论指出了经典物理学不能完全适用于微观粒子,提出了微观粒子运动特有的量子规律,开辟了当时原子物理学向前发展的新途径.
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。