-
原子半径 编辑
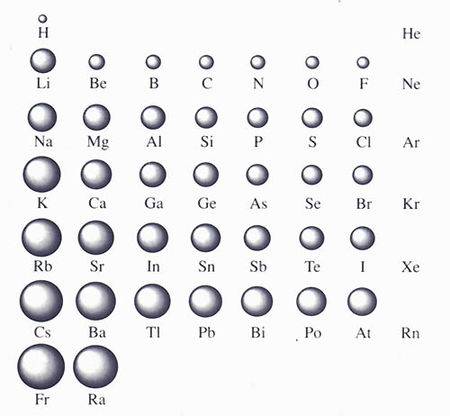
原子半径(Atomic Radius)是描述原子大小的参数之一。根据不同的标度和测量方法,原子半径的定义不同,常见的有轨道半径,范德华半径(也称范式半径),共价半径,金属半径等。同一原子依不同定义得到的原子半径差别可能很大,所以比较不同原子的相对大小时,取用的数据来源必须一致。原子半径主要受电子层数和核电荷数两个因素影响。一般来说,电子层数越多,核电荷数越小,原子半径越大。这也使得原子半径在元素周期表上有明显的周期递变性规律。原子半径对元素的化学性质有较大影响,所以对原子半径的研究在化学的发展中有着极其重要的意义和价值。
中文名:原子半径
外文名:Atomic Radius
影响因素:电子层数、质子数
矛盾因素:核电荷数和电子数
原子半径大小由上述一对矛盾因素决定。核电荷数增加使原子半径缩小,而电子数增加和电子层数增加使原子半径增加。当这对矛盾因素相互作用达到平衡时,原子就具有了一定的半径 。
我们只要比较上述这对矛盾因素相互作用的相当大小就不难理解不同原子半径大小的变化规律。
 原子半径
原子半径
例如,比较钠和镁的半径大小。
从钠到镁核电荷增加1个,其核对核外每一个电子都增加一定的作用力,原子趋向缩小,而核外电子也增加一个电子,因电子运动要占据一定空间而使原子半径趋向增加。实验证明,钠的原子半径大于镁,这说明增加的核电荷对原子半径的缩小作用>增加的电子对原子半径的增大作用。因此,同周期元素的原子从左到右逐渐减小(稀有气体除外)。
二.相邻周期元素原子半径大小比较。
实验结果钾原子半径>钠原子半径,这说明从钠到钾,增加的八个电子和增加的一个电子层对原子半径的增大作用>增加的八个核电荷对原子半径的缩小作用。所以,同主族元素的原子半径从上到下逐渐增加。氖到钠核电荷增加1个,核外电子和电子层均增加一个 ,由此推断,钠的半径>氖的半径,即:增加的一个电子和一个电子层对原子半径的增加作用>增加的一个核电荷对原子半径的缩小作用。值得注意的是,并不是电子层多的原子半径就一定大,如:锂原子半径>铝原子半径。这是因为当核电荷增加到大于八以后,其核对半径的缩小作用越来越强已经超过了增加一个电子层对半径的增加作用。
三.某原子及其阴离子或阳离子半径大小比较。
例如,氯原子和氯离子半径大小比较。
两者核电荷相同而氯离子多一个电子,这一电子运动要占据一定的空间,所以氯离子半径>氯原子半径。
原子及其阳离子半径正好与上述相反。例如:钠离子半径<钠原子半径。
四.电子层结构相同而核电荷不同的粒子半径大小比较。
例如,钠离子,镁离子,氧离子,氟离子半径大小比较。
因其核外电子层结构相同,显然核电荷越多核对核外电子引力越大则粒子半径越小。所以其粒子半径大小是:镁离子<钠离子<氟离子<氧离子。
 原子半径
原子半径
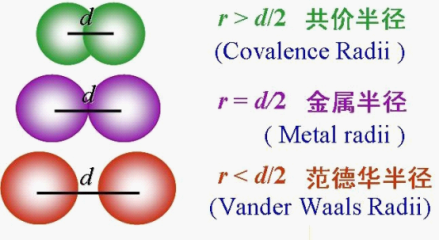
(1)共价半径:两原子之间(原子可以相同也可以不相同)以共价键结合时,两核间距离的一半。实际上核间距离即是共价键的键长。
(2)金属半径:金属晶体中相邻两金属原子间距离的一半。
(3)范式半径:靠范德华力相互吸引的相邻不同分子中的两个相同原子核间距离的一半。
 原子半径
原子半径
1.电子层数越多,原子半径就越大(适用于同主族)
2.同一周期元素,最外层电子数越多,原子半径越小。
3.电子数越多,原子半径越大。
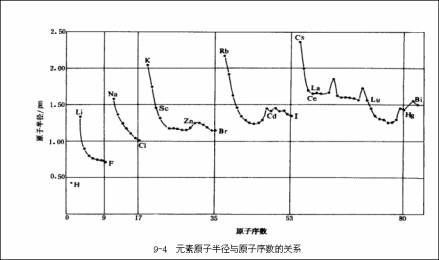 元素原子半径与原子序数关系
元素原子半径与原子序数关系
比较同一族元素就看电子层数。
如果两种元素的周期和族都不同,那么主要考虑电子层数,与最外层电子数一般没有关系。
如果将原子假设成一个球体的话,标准原子的直径大约为10的-10米。
2补充特别说明:指原子相互作用有效范围的一半,亦即相邻原子核间距的一半。则原子半径约为10^(-10)m。
根据相互作用力的不同,有以下几种有效半径:范德华半径、金属半径、离子半径和共价半径。
相互作用力
分子间的相互作用力(van der Waals forces)主要有:荷电基团、偶极子、诱导偶极子之间的相互作用,氢键、疏水基团相互作用,堆叠作用以及非键电子排斥作用等。
取向力(orientation force)
固有偶极之间的电性引力。
极性分子相互靠近时,因分子的固有偶极之间同极相斥异极相吸,使分子在空间按一定取向排列,使体系处于更稳定状态。这种固有的偶极间的作用力称为取向力。其实质是静电力。
诱导力(induction force)
诱导偶极与固有偶极之间的电性引力。
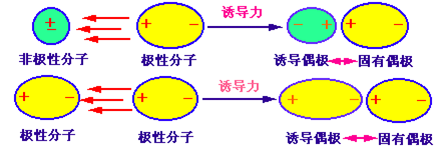 诱导力
诱导力
色散力 (dispersion force)
由于瞬时偶极的产生,引起的分子间的相互作用力,称为色散力。
总结:取向力,诱导力和色散力统称为van der Waals力。在极性分子之间存在取向力、诱导力和色散力,在极性分子和非极性分子之间存在诱导力和色散力,在非极性分子与非极性分子之间存在色散力。
氢键(hydrogen bond)
X—H…Y用来表示氢键,其中X—Hσ键的电子云偏向高电负性的X原子,导致出现屏蔽小的带正电性的氢原子核,它强烈地被另一个高电负性的Y原子所吸引。
氢键的一些特点:
1)方向性:由于H原子体积小,为了减少X和Y之间的斥力,它们尽量远离,键角接近180°,这就是氢键的方向性
2)饱和性:又由于氢原子的体积小,它与较大的X、Y接触后,另一个较大的原子就难于再向它靠近,所以氢键中氢的配位数一般为2,这就是氢键的饱和性。
范德华半径
分子间作用能E-r曲线会出现最低点。相应这最低点的距离即平衡距离。也就是说,当分子相互接近,到吸引和排斥达到平衡时,体系能量最低。此时分子间保持一定的接触距离。相邻分子相互接触的原子间的距离即为该两原子的范德华半径和。范德华半径比共价半径大,变动范围也大,即守恒性差 。
 金属半径示意图
金属半径示意图
金属原子半径在周期表中的变化有一定的规律性
1.同一周期的金属元素的原子半径,除个别例外,从左到右,先是逐渐减小,然后缓慢增加。
2.镧系收缩效应
受到镧收缩效应的影响,第二长周期比第一长周期同族元素的半径大,但第三长周期与第二长周期的同族元素的半径却极相近,Zr和Hf、Nb和Ta、Mo和W的半径极为近似,成为极难分离的元素,而Ru、Rh、Pd、Os、Ir、Pt 6个元素的原子半径和化学性质相似,通称铂族元素。
金属原子半径和配位数有关,配位数高,半径大。
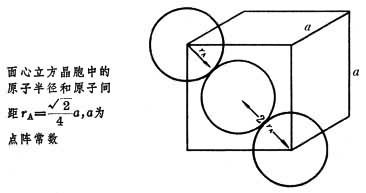
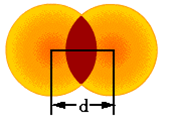 共价半径(d/2)示意图
共价半径(d/2)示意图
利用原子共价半径计算键长时应考虑下面两种情况
(1)异核原子间键长的计算值常常比实验测定值稍大。
共价键长的极性修正:Shomaker-Stevenson公式。
(2)同样一种化学键对不同分子有它的特殊性,键长也各有差异。例如同是C-C键,由于杂化形式发生改变,键中s轨道的成分发生变化时,C—C键长也发生变化,
当有离域∏键或其他复键存在时,就不能再用共价单键半径计算键长。反之,根据键长可以了解键的性质。
离子半径的测定
Lande离子半径
Lande(朗德)在1920年,通过对比下表(表中括号内的数字为后来较精确的测定值)中具有NaCl型结构的化合物的晶胞参数后,认为MgS和MgS、MgSe和MnSe的晶胞参数几乎相等,意味着在晶体中负离子和负离子已相接触。他利用简单的几何关系,推出S2-和Se2-的离子半径。
Wasastjerna(瓦萨斯雅那)离子半径
Wasastjerna(瓦萨斯雅那)在1925年按照离子的摩尔折射度正比于其体积的方法.划分离子的大小。获得8个正离子和8个负离子半径.括F-(133pm)和O2-(132 Pm)。
Goldschmidt(哥希密特)离子半径
Goldscbmidt(哥希密持)在1927年,采用Wasastjerna的F-和O2-的离子半径数据,根据实验测定的离子晶体中离子间的接触距离的数据,引出80多种离子的半径(Goldscbmidt离子半径),至今仍在通用。
Pauling离子半径
1927年Pauling据5个晶体(NaF、KCl、RbBr、CsI和Li2O)的核间距离数据,用半经验方法推出大量的离子半径。因为离子的大小由它最外层电子的分布所决定,而最外层电子的分布与有效核电荷成反比。
Shannon离子半径
Shanon等根据离子的配位数、配位多面体的几何构型、离子的自旋情况等条件,按不同条件下的接触距离推引离子半径。一套以O2-半径为140pm出发,另一套以O2-半径为132pm出发,得两套有效离子半径。
离子半径的大小有下列变化趋势
1) 同一主族,相同电荷离子,半径自上而下增大。
Li+<Na+<K+<Rb+<Cs+;F-<Cl-<Br-<I-
2) 同一周期元素核外电子数相同的正离子随着正电荷数的增加离子离子半径显著下降。
3) 同一元素核外各种价态的离子,电子数越多,离子半径越大。
4) 核外电子数相同的负离子对,随着负电价增加,半径略有增加,但增加值不大。
5) 镧系元素三价正离子的半径,从La3+到Lu3+依次下降,此为镧系收缩效应所引起。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。