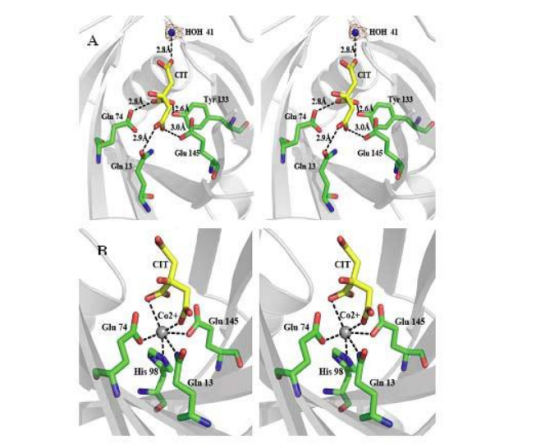
-
反常散射 编辑
晶体衍射中有一条弗里德耳定律,就是说不论晶体中是否存在对称中心,在晶体衍射中总存在着对称中心。但是当使用的X射线波长与待测样品中某一元素的吸收边靠近时,就不遵从上述定律。这是由电子的反常散射造成的,利用这一现象可以解决待测物的相角问题。
目录
应该指出,对于实测的衍射强度一般足以单独确定晶体结构的认识,在直接法测定晶体结构的发展史上是 一个里程碑。 因为大约在1950年前,结晶学界一直持有与此相反的错误观点,认为晶体结构即使在原则上也不可能从衍射强度中推引出来,而且已形成一种心理障碍。 要取得实质性的进展,就必须消除这种障碍。
随着同步辐射X光源日渐广泛地应用于结构分析,反常散射效应的应用将更具重要意义。使用同步辐射X光源可以更精确地测量反常散射效应。更重要的是,同步辐射X光的波长可以在大范围内连续调节。因此原则上对任何成分的单晶体试样,都不难从实验上获得大量准确的反常散射数据。由此可以推引出几十个乃至几百个起始相位。 现有直接法的各种技巧如果以这样一个可靠的“大起始套”作为基础,将有可能解出更复杂得多的结构。
小角X射线散射可以获得蛋白质在溶液中的形状,根据这个形状和一套任意波长的蛋白质单晶衍射数据, 可以通过六维搜索的方法确定出晶胞中蛋白质所处的位置和取向,因此皆可以得到这个蛋白质晶体的低分辨结构模型。但是这个低分辨模型仅仅利用晶体学的方法难以扩展到高分辨率的数据上去。
利用光学中的一些算法,例如杂化输入-输出算法(Hybrid-Input-Output,HIO)或者改进的杂化输入-输出算法(Modified Hybrid-Input-Output, MHIO),成功地把低分辨的相位扩展到任意分辨率的衍射数据中,从而实现相位的解析。这种算法对衍射数据的误差非常不敏感,并且对衍射的分辨率没有要求,只要在低蛋白质进行结晶之前进行小角散射实验,获得蛋白质在溶液中的低分辨形状,获得晶体以后收集一套任意波长的衍射数据,就能够解析出蛋白质晶体结构,可望成为解析全新结构的一种有力的新方法。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。