-
玻尔理论 编辑
玻尔理论是指一种关于原子结构的理论。1913年由玻尔提出。是在卢瑟福原子模型基础上加上普朗克的量子概念后建立的。
中文名:玻尔理论
外文名:Bohr Theory
提出者:玻尔
提出时间:1913年
适用领域:结构化学
应用学科:物理
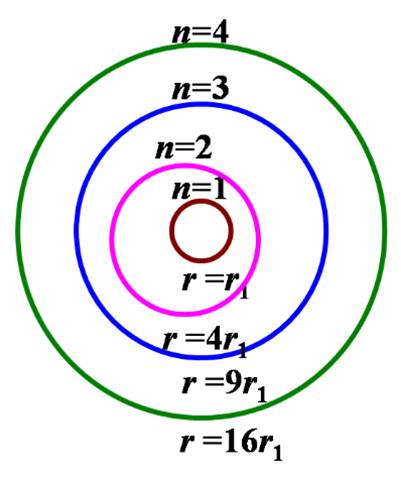
核外电子只能在某些特定的(有确定的半径和能量)圆形轨道上绕核运动,电子在%20这些符合量子化条件的轨道上运动时,处于稳定状态,这些轨道的能量状态不随时间而改%20变%20,因而被称为定态轨道。在定态轨道上运动的电子既不吸收能量,也不放出能量。
电子在不同轨道上运动时,其能量是不同的。轨道离核愈远,能量愈高。当原子中%20的电子处于离核最近的轨道时,它们处于最低的能量状态,称为基态。当原子从外界获得%20能量时,电子可以跃迁到离核较远、能量较高的轨道上,这种状态称为激发态。电子的能量是量子化的,它不可能处于两个允许的相邻轨道的能量之间。
电子在能量不同的轨道之间跃迁时,原子才会吸收或放出能量。处于激发态的电%20子不稳定,可以跃迁到离核较近的轨道上,同时释放出光能。释放出光能(光的频率)的%20大小决定于两轨道之间的能量差,其关系式为:
式%20中%20
但是%20,玻尔的原子模%20型却无法说明多电子原子的光谱,甚至不能说明氢原子光谱的精细结构。也就是说,玻尔%20理论虽然引用了普朗克的量子化概念,却没有跳出经典力学的范围。而电子的运动并不%20遵循经典物理学的力学定律,而是具有微观粒子所特有的规律性——波粒二象性,这种特殊的规律性是玻尔在当时还没有认识到的。%20
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。