-
氧 编辑
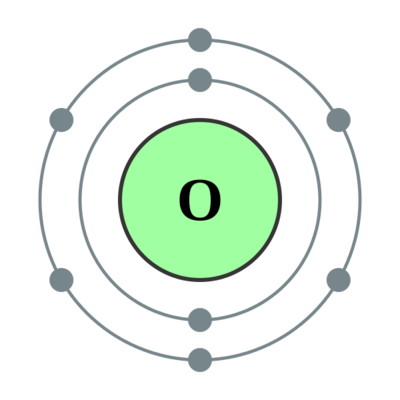
氧(Oxygen),元素周期表第二周期第16族非金属元素,元素符号O,原子序数8,相对原子质量15.9994。氧是地壳中最丰富、分布最广的元素,也是构成生物界与非生物界最重要的元素,在地壳的含量为48.6%。单质氧在大气中占20.9%。氧密度为1.404g/L,液态相对密度为1.149(-183℃),固态相对密度为1.426(-252.5℃),熔点-218.79℃,沸点-182.95℃。氧不易溶于水、乙醇和有机溶剂,电负性仅次于氟,所有化学元素都能与氧直接或间接化合生成各类氧化物;除惰性气体、卤素及一些不活泼金属(如金、铂等)外,氧能与所有的金属和非金属直接反应。可与活泼金属形成过氧化物和超氧化物。实验室可用氯酸钾或硝酸钾热分解制备,也可用重金属氧化物热分解或金属过氧化物与水和酸反应制备;工业上采用液态空气分馏方法制备。氧气是动物维持生命过程和燃烧过程的必要物质,还广泛应用于冶金、化工、环保等领域。2023年,科学家首次创造出含有8个质子和20个中子的氧同位素:氧-28。
中文名:氧
外文名:Oxygen
分子量:32(注:氧气分子有两个原子,氧原子量为16)
CAS登录号:7782-44-7
EINECS登录号:231-956-9
熔点:-218.79 ℃
沸点:-182.95 ℃
水溶性:不易溶于水
密度:1.404 g/dm³
外观:无色、无臭、无毒、无味气体
闪点:421.9 ℃
应用:气焊、医疗用氧
安全性描述:S17;S45;S36/37/39;S26;S61
危险性符号:R8
危险性描述:O
UN危险货物编号:1072
原子序数:8
常见氧化态:-2,-1,0
构成单质:氧气(O2),臭氧(O3)等
原子量:15.9994(通常取16)
元素符号:O
周期:第二周期
区:p区
电子排布:2s22p4
电负性:3.44(鲍林标度)
稳定同位素:16O,17O,18O
1608年,Cornelius Drebbel证明了加热硝石(硝酸钾,KNO₃)能释放气体。这就是氧气,然而并没有对它进行鉴定。
1615年,荷兰化学家C.J.Drebbel曾通过加热硝酸钾制得氧气,并且把氧气用在水下潜艇中。
1678年,英国化学和物理学家R.Boyle以及O.Borch曾分别加热硝石制得氧气。
1731年,Halec通过加热硝石制取氧气,并在水上收集之。
1774年,法国医药视察员P.Bayen在曲颈甑中加热氧化汞获得了氧气。
1774年,英国科学家约瑟夫·普里斯特利(J.Joseph Priestley)用透镜把太阳光聚焦在氧化汞上,发现一种能强烈帮助燃烧的气体。安托万-洛朗·拉瓦锡(Antoine-Laurent de Lavoisier)研究了此种气体,并正确解释了这种气体在燃烧中的作用。
 舍勒
舍勒
因发现氧而获得的荣誉由3位化学家分享:一个英国人,一个瑞典人,还有一个法国人。约瑟夫·普里斯特利是第一位发布氧元素声明的人,在1774年由聚焦阳光到氧化汞(HgO),然后收集释放出的气体实现。他注意到蜡烛在这里燃烧的更明亮了,而且能使呼吸变得更简单。普里斯特利不知道的是,卡尔·威尔海姆·舍勒(Carl Wilhelm Scheele)在1771年6月就制取了氧。他写下了他的发现说明,但直到1777年才发布。拉瓦锡也声称发现了氧,并且他提议这种新的气体叫做oxy-gène,意思是形成酸的,因为他认为这种元素是所有酸性物质的基础。
2018年5月16日,大阪产业大学、日本国立天文台及名古屋大学等组成的团队宣布,使用南美智利的ALMA射电望远镜发现距地球132.8亿光年的狮子座方向银河中存在氧。
2023年,东京工业大学近藤洋介团队及多国研究人员通过将氟原子高能束粉碎成液态氢,首次创造出含有8个质子和20个中子的氧同位素:氧-28。
物理性质
 液态氧
液态氧
化学性质
氧的非金属性和电负性仅次于氟,除了氦、氖、氩、氪,所有元素都能与氧起反应。一般而言,绝大多数非金属氧化物的水溶液呈酸性,而碱金属或碱土金属氧化物则为碱性。此外,大多数有机化合物,可在氧气中燃烧生成二氧化碳与水蒸气,如酒精,甲烷。部分有机物不可燃,但也能和氧气等氧化剂发生氧化反应。
氧的化合价:氧的化合价很特殊一般为-2价和0价。而氧在过氧化物中通常为-1价。在超氧化物中为-1/2,臭氧化物中氧为-1/3,这里的化合价被称为表观化合价,就是表面上看出来的化合价没有实际的含义,超氧化物中氧的化合价只能说是超氧根离子,不能单独的看每个原子,因为电子是量子化的,即不连续的,不存在1/2个电子,自然化合价也就没有0.5的说法,臭氧化物也一样,在过氧根中相当于是有两个电子组成了电子对,所以这两个电子不表现出化合价,所以过氧根离子整体呈-2价。而氧的正价很少出现,只有在和氟的化合物二氟化氧,二氟化二氧和氟铂酸氧(O₂PtF₆)中显示+2价和+1价以及+0.5价。
 氧气瓶
氧气瓶
在元素周期表中属于ⅥA族元素,化合价一般为0和-2。大多数元素在含氧的气氛中加热时可生成氧化物。有许多元素可形成一种以上的氧化物。氧分子在低温下可形成水合晶体O₂·H₂O和O₂·H₂O₂,后者较不稳定。氧气在水中的溶解度是4.89毫升/100毫升水(0℃),是水中生命体的基础。氧在地壳中丰度占第一位。干燥空气中含有20.946%体积的氧;水有88.81%重量的氧组成。除了16O外,还有17O和18O等同位素。 常见氧化态有-1,-2,0。共价半径66 pm,第一电离势1314kJ/mol,电负性3.44。
实验室制法
1.加热高锰酸钾或锰酸钾:
2.二氧化锰与氯酸钾共热%20:
3.过氧化氢溶液催化分解(催化剂主要为二氧化锰,三氧化二铁、氧化铜也可以):
工业制法
分离液态空气法
在低温条件下加压,使空气转变为液态,然后蒸发,由于液态氮的沸点是‐196℃,比液态氧的沸点(‐183℃)低,因此氮气首先从液态空气中蒸发出来,剩下的主要是液态氧。
空气中的主要成分是氧气和氮气。利用氧气和氮气的沸点不同,从空气中制备氧气称空气分离法。首先把空气预冷、净化(去除空气中的少量水分、二氧化碳、乙炔、碳氢化合物等气体和灰尘等杂质)、然后进行压缩、冷却,使之成为液态空气。然后,利用氧和氮的沸点的不同,在精馏塔中把液态空气多次蒸发和冷凝,将氧气和氮气分离开来,得到纯氧(可以达到99.6%的纯度)和纯氮(可以达到99.9%的纯度)。如果增加一些附加装置,还可以提取出氩、氖、氦、氪、氙等在空气中含量极少的稀有惰性气体。由空气分离装置产出的氧气,经过压缩机的压缩,最后将压缩氧气装入高压钢瓶贮存,或通过管道直接输送到工厂、车间使用。使用这种方法生产氧气,虽然需要大型的成套设备和严格的安全操作技术,但是产量高,每小时可以产出数千、万立方米的氧气,而且所耗用的原料仅仅是不用买、不用运、不用仓库储存的空气,所以从1903年研制出第一台深冷空分制氧机以来,这种制氧方法一直得到最广泛的应用。
膜分离技术
膜分离技术得到迅速发展。利用这种技术,在一定压力下,让空气通过具有富集氧气功能的薄膜,可得到含氧量较高的富氧空气。利用这种膜进行多级分离,可以得到百分之九十以上氧气的富氧空气。
分子筛制氧法(吸附法)
利用氮分子大于氧分子的特性,使用特制的分子筛把空气中的氧分离出来。首先,用压缩机迫使干燥的空气通过分子筛进入抽成真空的吸附器中,空气中的氮分子即被分子筛所吸附,氧气进入吸附器内,当吸附器内氧气达到一定量(压力达到一定程度)时,即可打开出氧阀门放出氧气。经过一段时间,分子筛吸附的氮逐渐增多,吸附能力减弱,产出的氧气纯度下降,需要用真空泵抽出吸附在分子筛上面的氮,然后重复上述过程。这种制取氧的方法亦称吸附法.利用吸附法制氧的小型制氧机已经开发出来,便于家庭使用。
电解法制氧气
把水放入电解槽中,加入氢氧化钠或氢氧化钾以提高水的电解度,然后通入直流电,水就分解为氧气和氢气。每制取一立方米氧气,同时获得两立方米氢气。用电解法制取一立方米氧气要耗电12~15千瓦时,与上述两种方法的耗电量(0.55~0.60千瓦时)相比,是很不经济的。所以,电解法不适用于大量制氧。另外同时产生的氢气如果没有妥善的方法收集,在空气中聚集起来,如与氧气混合,容易发生极其剧烈的爆炸。所以,电解法也不适用于家庭制氧。
电解硫酸铜溶液 | |
|---|---|
肺型氧中毒
类似支气管肺炎。其表现及通常的发展过程为:最初为类似上呼吸道感染引起的气管刺激症状,如胸骨后不适(刺激或烧灼感)伴轻度干咳,并缓慢加重;然后出现胸骨后疼痛,且疼痛逐渐沿支气管树向整个胸部蔓延,吸气时为甚;疼痛逐渐加剧,出现不可控制的咳嗽;休息时也伴有呼吸困难。在症状出现的早期阶段结束暴露,胸疼和咳嗽可在数小时内减轻。
脑型氧中毒
最初出现额、眼、鼻、口唇及面颊肌肉的纤维性颤动,也可累及手的小肌肉;面色苍白、有异味感。继而可有恶心、呕吐、眩晕、汗、流涎、上腹部紧张;也可出现视力丧失、视野缩小、幻视、幻听;还会有心动过缓、心悸、气哽、指(趾)端发麻、情绪反常(忧虑、抑郁、烦躁或欣悦)。接着出现极度疲劳、嗜睡、呼吸困难等。少数情况还可能发生虚脱。
眼型氧中毒
主要表现为视网膜萎缩。早产婴儿在恒温箱内吸氧时间过长,视网膜有广泛的血管阻塞、成纤维组织浸润、晶体后纤维增生,可因而致盲。
来源
本品含O2不得少于99.5%(mL/mL)。
性状
本品为无色气体,无臭,无味,有强助燃力。
本品1容在常压20°C时,能在乙醇7容或水32容中溶解。
鉴别
本品能使炽红的木条突然发火燃烧。
检查
酸碱度
取甲基红指示液与溴麝香草酚蓝指示液各0.3mL,加水400mL,煮沸5分钟,放冷,分取各100mL,置甲、乙、丙3支比色管中,乙管中加盐酸滴定液(0.01mol/L)0.20mL,丙管中加盐酸滴定液(0.01mol/L)0.40mL,再在乙管中通本品2000mL(速度为每小时4000mL),乙管显出的颜色不得较丙管的红色或甲管的绿色更深。
一氧化碳
取甲、乙2支比色管,分别加微温的氨制硝酸银试液25mL,甲管中通本品1000mL(速度为每小时4000mL)后,与乙管比较,应同样澄清无色。%20
二氧化碳
取甲、乙2支比色管,分别加5%氢氧化钡溶液100mL,乙管中加0.04%碳酸氢钠溶液1.0mL,甲管中通本品1000mL(速度为每小时4000mL)后,所显浑浊与乙管比较,不得更浓(0.01%)。
其他气态氧化物质
取新制的碘化钾淀粉溶液(取碳化钾0.5g,加淀粉指示液100mL溶解,即得)100mL,置比色管中,加醋酸1滴,通本品2000mL(速度为每小时4000mL)后,溶液应无色。
含量测定
仪器装置%20
如图:%20A、C为总容量约300mL的吸收器,B为适宜的塞子,D、E及I为细玻璃导管,F为刻度精密至0.1mL、容量为100mL的量气管主体,G为三通活塞,H为气体进出口,J为平衡瓶。临用前用橡胶管将吸收器与量气管连接,后者再与平衡瓶连接。
测定法
先将铜丝节(取直径约0.8mm的紫铜丝缠成直径约4mm的铜丝卷并剪成长约10mm的小节)装满于吸收器A中,用塞B塞紧,再将氨-氯化铵溶液(取氯化铵150g,加水200mL,随搅随小心加浓氨溶液200mL,混匀)导入,使充满A并部分留于C中,再将饱和氯化钠溶液注入平衡瓶J中,提高平衡瓶,使饱和氯化钠溶液充满F,多余溶液由H流出,转动G接通拱气管与吸收器,下降平衡瓶使吸收器中的溶液全部充满导管D、E、I和活塞G的入口,立即关闭活塞,如有气体和部分氨-氯化铵溶液进入量气管时,可提高平衡瓶转动活塞,使由H排出。
将供试品钢瓶接上减压阀(专供氧气用),后者出口接上橡胶管,小心微开钢瓶气阀,再开减压阀使氧气喷放1分钟后,调整至较弱的气流。
将橡胶管另一端连接在气体进出口H上,俟量气管装满本品后,关闭G并立即拆去气体进出口H上的橡胶管,静置数分钟,转动G接通气体进出口H,将平衡瓶徐徐升降(为防止吸入外界空气,应注意使平衡瓶内的液面略高于量气管内的液面),使量气管内的液面恰达刻度100mL处。转动G接通量气管与吸收器,举起平衡瓶使供试品进入吸收器A中,当饱和氯化钠溶液流经导管I并充满导管D时,关闭G并将吸收器A小心充分振摇5~10分钟,俟气体被吸收近完毕时(所剩者为氮或其他不被吸收的气体),转动G接通量气管与吸收器,降低平衡瓶,将剩余气体由吸收器转入量气管中,当氨-氯化铵溶液充满吸收器A并经导管D、E与I通过活塞G时,关闭活塞。
约5分钟后,调节平衡瓶的液面使量气管内的气体压力与大气压力一致,读出量气管内的液面刻度,算出供试品的含量。
为了检查氧是否完全被吸收,应重复上述操作,自“转动G接通量气管与吸收器,举起平衡瓶”起,依法操作,至剩余的气体体积恒定为止(二次差不大于0.05mL)。
检查或测定前,应先将供试品钢瓶在试验室温度下放置6小时以上。
类别
用于缺氧的预防和治疗。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。