-
渗透压 编辑
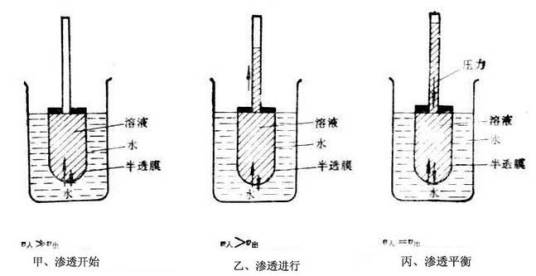
对于两侧水溶液浓度不同的半透膜,为了阻止水从低浓度一侧渗透到高浓度一侧而在高浓度一侧施加的最小额外压强称为渗透压。渗透压与溶液中不能通过半透膜的微粒数目和环境温度有关。
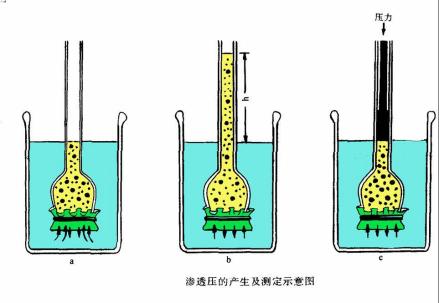 渗透压产生与测量示意图
渗透压产生与测量示意图
(1) 在温度一定时,稀溶液的渗透压力与溶液的浓度成正比
(2) 在浓度一定时,稀溶液的渗透压力与热力学温度成正比
1886年荷兰理论化学家范托夫(van't Hoff)从理论上推导出难挥发非电解质稀溶液的渗透压力与溶液浓度和热力学温度的关系为:
上式称为范托夫公式,也叫渗透压公式。
c为摩尔浓度,单位:mol/L,也可以算作C=n/V(物质的量(mol)/体积(L))。
R为理想气体常数,当π的单位为kPa,V的单位为升(L)时,R值为8.314J·K-1·mol-1。
T为热力学温度,单位:K(开尔文),与摄氏度的换算关系是%20T(K)%20=%20273+T(C),例:25摄氏度=298开尔文。
范托夫公式表示,在一定温度下,溶液的渗透压与单位体积溶液中所含不能通过半透膜的溶质的粒子数(分子数或离子数)成正比,而与溶质的本性无关。
解释
依数性
由于平衡渗透压遵循理想气体定律(稀溶液中忽略溶质分子的相互作用),这个数学推导过程在这里省略,最后可以得出范特霍夫关系:π=cRT(或π=kTN/V;N/V为分子数密度),从公式可知溶液的渗透压只由溶质的分子数决定,因而渗透压也是溶液的依数性。这个关系给出的不是真正的压强,而是阻止渗透流可能需要的压强,即系统达到平衡所需要的压强差。
小颗粒能够有效的帮助大分子找到彼此特异性识别位点,在生物学实验中,常用血清蛋白(BSA)和聚乙二醇(PEG)充当小颗粒,它们称为阻塞试剂。比如他们可以帮助脱氧血红蛋白和其他大蛋白粘在一起,溶解性降低10 倍;葡聚糖或PEG 能稳定复合物不受热分解,可以使DNA 溶解度增加若干;PEG 和BSA 还能使机动蛋白丝自组装速率或不同酶的活性增加几个数量级;在大肠杆菌DNA 复制系统中如果不加入阻塞试剂就不能工作。选择何种阻塞试剂并不重要,关键是他相对组装分子的尺度及数密度。这是无序状态过程中同时驱动的有序组装,这个的有序是以更小颗粒更大的无序为代价的。
1886年范特霍夫根据实验数据得出一条规律:对稀溶液来说,渗透压与溶液的浓度和温度成正比,它的比例常数就是气体状态方程式中的常数R。这条规律称为范特霍夫定律。
原理为将溶液和水置于U型管中,在U型管中间安置一个半透膜,以隔开水和溶液,可以见到水通过半透膜往溶液一端跑,若于溶液端施加压力,而此压力可刚好阻止水的渗透,则称此压力为渗透压,渗透压的大小和溶液的质量摩尔浓度、溶液温度和溶质解离度相关,因此有时若得之渗透压的大小和其他条件,可以反推出大分子的分子量。范特霍夫因为渗透压和化学动力学等方面的研究获得第一届诺贝尔化学奖。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。