-
凝胶电泳 编辑
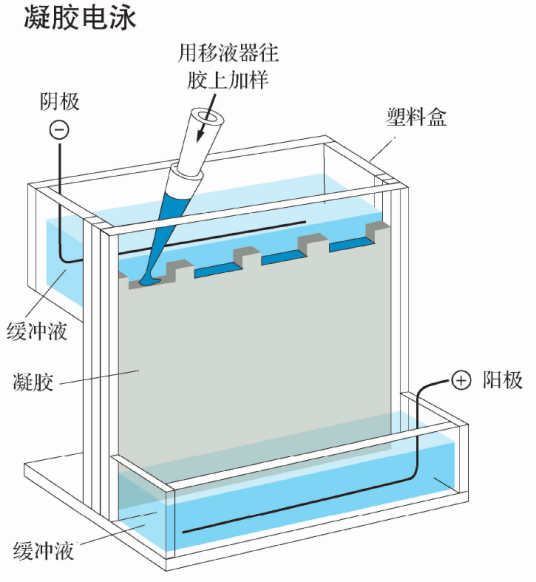
DNA分子提取得到以后,需要通过电泳技术来检测其数量和质量。自从琼脂糖和聚丙烯酰胺凝胶被引入核酸研究以来,按相对分子质量大小分离DNA的凝胶电泳技术,已经发展成为一种分析鉴定DNA分子的重要实验手段。琼脂糖或聚丙烯酰胺凝胶电泳是基因操作的核技术之一,它能够用于分离、鉴定和纯化DNA片段。该技术操作简单而迅速,已经成为许多通用的分子生物学研究方法,如DNA重组、DNA核苷酸序列分析、DNA限制性内切酶分析及限制性酶切作图等的技术基础。
琼脂糖是一种线性多糖聚合物,是从红色海藻产物琼脂中提取而来的。当琼脂糖溶液加热到沸点后冷却凝固便会形成良好的电泳介质,其密度是由琼脂糖的浓度决定的。经过化学修饰的低熔点(LMP)的琼脂糖,在结构上比较脆弱,因此在较低的温度下便会熔化,可用于DNA片段的制备电泳。
聚丙烯酰胺凝胶主要有两种方式:一是用于分离和纯化双链DNA片段的非变性聚丙烯酰胺凝胶。在未变凝胶中分离DNA的缺点是DNA的迁移率受碱基组成和序列的影响。由于无法得知未知DNA的迁移是否反常,故不能用未变性的聚丙烯酰胺凝胶电泳确定双链DNA的大小。二是用于分离及纯化单链DNA片段的变性聚丙烯酰胺凝胶。这类聚丙烯酰胺凝胶是在核苷酸碱基配对抑制剂(尿素或甲酰胺)的存在下聚合而成,变性DNA的移动速度同其碱基组成及序列几乎完全无关,故可用于分离及纯化单链DNA片段和DNA测序等。
(2)脉冲电场凝胶电泳
普通的凝胶电泳技术显然是无法分离如此超大分子量的DNA分子的。1984年,D.C.Schwartz和C.R.Cantor发明的脉冲电场凝胶电泳技术,可以成功地用来分离整条染色体这样的超大分子量的DNA分子。在常规的琼脂糖凝胶电泳中,超过一定大小范围的所有的双链DNA分子,都是按相同的速率迁移的。这是因为它们在单向恒定电场的作用下,仅以“一端向前”的方式游动穿过整个胶板。而在脉冲电场中,DNA分子的迁移方向是随着所用的电场方向的周期性变化而不断改变的。
在标准的PFGE中,头一个脉冲的电场方向与核酸移动方向成45°夹角,而下一个脉冲的电场方向与核酸移动方向在另一侧亦成45°夹角。由于加压在琼脂糖凝胶上的电场方向、电流大小及作用时间都在交替地变换着,这就使得DNA分子能够随时地调整其游动方向,以适应凝胶孔隙的无规则变化。与分子量较小的DNA分子相比,分子量较大的DNA分子需要更多的次数来更换其构型和方位,以使其可以按新的方向游动。因此,在琼脂糖介质中的迁移速率也就显得更慢一些,从而达到分离超大分子量DNA分子的目的。应用脉冲电场凝胶电泳技术,可成功地分离到分子量高达107bp的DNA大分子。
(1)DNA的分子大小
线状双链DNA分子在一定浓度琼脂糖凝胶中的迁移速率与DNA分子量对数成反比,分子越大则所受阻力越大,也越难于在凝胶孔隙中蠕行,因而迁移得越慢。
(2)琼脂糖浓度
一个给定大小的线状DNA分子,其迁移速度在不同浓度的琼脂糖凝胶中各不相同。DNA电泳迁移率的对数与凝胶浓度成线性关系。凝胶浓度的选择取决于DNA分子的大小。分离小于0.5kb的DNA片段所需胶浓度是1.2-1.5%,分离大于10kb的DNA分子所需胶浓度为0.3-0.7%,DNA片段大小间于两者之间则所需胶浓度为0.8-1.0%。
(3)DNA分子的构象
DNA分子处于不同构象时,它在电场中移动距离不仅和分子量有关,还和它本身构象有关。相同分子量的线状、开环和超螺旋DNA在琼脂糖凝胶中移动速度是不一样的,超螺旋DNA移动最快,而开环双链DNA移动最慢。如在电泳鉴定质粒纯度时发现凝胶上有数条DNA带难以确定是质粒DNA不同构象引起还是因为含有其他DNA引起时,可从琼脂糖凝胶上将DNA带逐个回收,用同一种限制性内切酶分别水解,然后电泳,如在凝胶上出现相同的DNA图谱,则为同一种DNA。
(4)电源电压
在低电压时,线状DNA片段的迁移速率与所加电压成正比。但是随着电场强度的增加,不同分子量的DNA片段的迁移率将以不同的幅度增长,片段越大,因场强升高引起的迁移率升高幅度也越大,因此电压增加,琼脂糖凝胶的有效分离范围将缩小。要使大于2kb的DNA片段有效分离所加电压不得超过5V/cm。
(5)嵌入染料的存在
荧光染料溴化乙啶用于检测琼脂糖凝胶中的DNA,染料会嵌入到堆积的碱基对之间并拉长线状和带缺口的环状DNA,使其刚性更强,还会使线状DNA迁移率降低15%。
(6)离子强度影响
电泳缓冲液的组成及其离子强度影响DNA的电泳迁移率。在没有离子存在时(电导率最小,DNA几乎不移动,在高离子强度的缓冲液中(如误加10×电泳缓冲液),则电导很高并明显产热,严重时会引起凝胶熔化或DNA变性。
追踪传染源
脉冲场凝胶电泳用于评估同一事件中不同来源菌株可能存在的关系,是溯源的有用技术之一。当疫情爆发时, 为了采取有针对性的措施,对该疫情进行合理有效地防控, 需要明确导致疾病爆发的根本原因。脉冲场凝胶电泳技术可以在看上去分散无关系的病例中寻找关键联系,追踪传染源,最终达到预防和控制疾病的目的。
分子分型
目前(2012年),脉冲场凝胶电泳是国内外在分子流行病学研究中被广泛接受的方法之一,被认为是细菌分子生物学技术的“金标准”,与核糖体分型相比较,脉冲场凝胶电泳的分型能力更强。脉冲场凝胶电泳分型技术是现阶段霍乱流行病学调查中使用最普遍的分子分型方法。
分子流行病学研究
脉冲场凝胶电泳技术由于比表型鉴定和Southern杂交技术在区分亚种时更具优势, 所以已经成为分子流行病学研究中最有效的手段。研究表明, 脉冲场凝胶电泳在医院感染爆发流行疾病的鉴定上与PCR指纹图谱分型同样有效,并有着自己独特的优势。
在兽医领域的应用
1996年,有学者通过进行同工酶分析与脉冲场凝胶电泳开展对牛分枝杆菌和其他复杂肺结核分枝杆菌属的基因组分析。结果表明,脉冲场凝胶电泳是一种对牛结核分枝杆菌流行病学研究具有高度鉴别力的技术,它可以在结核独立爆发的动物中培养、分离牛结核分枝杆菌进行分型,并确定感染源,显示一定地域中由不同菌株造成多重感染可能性的存在。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。