-
指示剂 编辑
指示剂,是一类化学试剂。在一定介质条件下,其颜色能发生变化、能产生浑浊或沉淀,以及有荧光现象等。常用它检验溶液的酸碱性;滴定分析中用来指示滴定终点;环境检测中检验有害物。一般分为酸碱指示剂、氧化还原指示剂、金属指示剂、吸附指示剂等。指示剂用以指示滴定终点的试剂。在各类滴定过程中,随着滴定剂的加入,被滴定物质和滴定剂的浓度都在不断变化,在等当点附近,离子浓度会发生较大变化,能够对这种离子浓度变化作出显示(如改变溶液颜色,生成沉淀等)的试剂就叫指示剂。如果滴定剂或被滴定物质是有色的,它们本身就具有指示剂的作用,如高锰酸钾。
2、金属指示剂:络合滴定法所用的指示剂,大多是染料,它在一定pH下能与金属离子络合呈现一种与游离指示剂完全不同的颜色而指示终点。
3、氧化还原指示剂:为氧化剂或还原剂,它的氧化形与还原形具有不同的颜色,在滴定中被氧化(或还原)时,即变色,指示出溶液电位的变化。
4、吸附指示剂:是容量沉淀法中所用的一类指示剂。一般是能被滴定过程中生成的沉淀所吸附而改变其颜色的某些有机染料
5、沉淀滴定指示剂:主要是Ag+与卤素离子的滴定,以铬酸钾、铁铵矾或荧光黄作指示剂。
17世纪
波义耳1627年生于爱尔兰的利兹莫尔堡,1691 年死于伦敦。他的父亲是伯爵考克一世。开始波义耳在伊顿求学,其后游学欧洲大陆,1644年回国,父亲死去后,他过着十分简朴的生活。1654年移居牛津,在高街与大学学院相邻的住宅里,同助手进行了一段时期的抽气机及燃烧等实验工作。1668年,他移居伦敦。他是最早的皇家学会会员之一。1680年波义耳被选为英国皇家学会主席,但他谢绝了这个职务。波义耳是一位出色的实验家,很善于观察事物的一些细微变化。在16 世纪或者更早一点,人们就已经认识到某些植物的汁液具有着色剂的功效,在那个时候,法国人就已经用这些植物的汁液来染丝织品。也有一些人观察到许多植物汁液在某种物质的作用下可改变它们的颜色,例如有人观察到酸能使某些汁液转变成红色,而碱则能够把它们变成绿色和蓝色。但是,因为在那个时候还没有任何人对酸和碱的概念下过确切的定义,所以这些酸和碱能够改变汁液的颜色的化学现象并未受到人们的注意和重视。
科学家才真正开始阐述一些基本的化学概念,其中一个非常重要的概念就是把化合物划分成为酸、碱、盐三大类别,最早和最明确的有关酸的定义便是波义耳作出的。
他所描绘的酸的各种特性中,有一条就是酸能够改变某些植物的汁液的颜色,这也就是人类对指示剂这种物质的最原始的认识。波义耳在他的“颜色的试验”一书中曾描写了怎样用植物的汁液来做指示剂。他曾经使用过的植物的种类很多,其中有紫罗兰、玉米花、玫瑰花、雪米、苏木(即巴西木)、樱草、洋红和石蕊。在书中还介绍了用指示剂制作试纸的方法,以及怎样使用这些试纸:“采用上好的紫罗兰的浆汁(即由这种花里浸渍出来的染料),把这种浆汁滴在一张白纸上,然后再在汁液上滴上2~3滴酒精,以后,当醋或者几乎所有的其他的带酸性溶液(当时已经制出的酸并不多)滴在这种浸有植物的浆汁和酒精的混合物的纸上时,你就会发现浸有植物浆汁的纸立即由蓝色转变成红色。使用这种方法的好处是,在进行实验时出的是,这种发明的生命力是如此的长久,我们的实验室还仍然在经常性的使用这种原始的方法。
在波义耳之后,很多化学家都陆续发表了不少报告,报告都是描述如何把植物的浆汁作为指示剂。
像布尔哈夫(1668 年~1738 年)在他的报告中叙述了怎样利用指示剂来鉴别碱性化合物,他最常使用的指示剂便是紫罗兰和石蕊的汁液。随着指示剂使用的日趋广泛,大家对它的研究更加深入,例如在18 世纪,许多人发现,各种酸并不能使这些指示剂精确地显示出相同的颜色变化。也就是说,各种指示剂的灵敏度不一样,颜色的变化范围不同,各种酸的强度也不相同,因此才造成这种情况。
1729年
法国化学家日夫鲁瓦也曾利用酸碱滴定的方法来测定酸的浓度,例如醋的浓度。他先称出一定重量的碳酸钾固体,然后把它溶解在水中,接着把醋酸一滴一滴地加到碳酸钾溶液中,一直加到不发生气泡为止。从消耗掉的碳酸钾的数量,便可以计算出各种醋的相对浓度。可以看出,格劳贝尔和日夫鲁瓦都是利用发泡的现象来指示酸碱中和反应的终点。
1767年
路易斯曾经假定酸碱中和反应的终点能够运用植物的汁液来显示和标记出来,他在《对美洲草木灰的试验和观察》一书中描述了这样一种简单的测定方法:“在酸碱中和的反应过程中,中和碱液所需要的酸可以一滴一滴地加进去,过去一直是利用发泡现象来观察反应的终点,但是这种方法最终还是存在着一定的缺陷,这种方法不但观察起来很困难,而且也达不到相当高的精确性。如果我们能利用植物的浆汁或者被这些浆汁着色的纸所发生的颜色变化来指示酸碱中和反应的终点,那么就能得到比较明显的结果,这就代替了那种含糊不清的现象(指发泡现象)。”路易斯紧接着介绍了具体的使用方法:“我主要使用的方法是一种十分敏锐的方法。利用一张厚的写字纸,在纸的一端浸渍上石蕊的浆汁,使它沾上蓝色;在纸的另一端又浸渍了石蕊的浆汁和盐酸的混合溶液,正好变成了红色。这时,如果将某些酸一滴一滴地加到碱溶液中去,每加一滴以后就用玻璃棒将溶液搅拌均匀,并用上那种着了颜色的试纸进行检测。如果这种溶液使试纸的红色的一端变成蓝色,那么便说明溶液此时还是呈碱性的,因此需要继续加酸液。
如果它刚好能够使试纸的蓝色的一端变成红色,则说明酸液已经加够了。以后的一百多年内,化学家在酸碱滴定中能使用的天然植物的浆汁的种类不多,并且他们常常认为这些浆汁(例如紫罗兰和石蕊的浆汁)的颜色变化不够清晰和灵敏。因此很多人都想改变这种状况,并且为此而进行了不懈的努力,最后导致了合成指示剂的产生和发展。
1775年
瑞典的贝格曼(1735年~1784年)就曾经指出:“蓝色植物的汁液的变色对各种酸的灵敏程度是不同的,硝酸能使某种蓝色的试纸变成红色;而醋则不能使同一种试纸变色。有的酸能够使蓝色的石蕊汁液变红色,却不能将紫罗兰的汁液转变成红色。由此可以知道,必须对所有的植物汁液(可以用作指示剂的)的灵敏性进行鉴定,然后才可找到一系列合适的指示剂来测定各种酸的相对浓度。”从这一段叙述我们可以看到,当时对指示剂的研究已经到相当深入和细致的阶段了。指示剂的另一种重要的运用领域便是酸碱滴定。
19世纪后
有机合成化学以惊人的速度发展起来,其中尤以合成染料工业的兴起最为引人注目。在这些合成染料中,很多化合物都能够起到指示剂的作用。第一个可供实用并且真正获得成功的合成指示剂便是酚酞,1877年吕克首先提出在酸碱中和反应过程中可以使用酚酞做指示剂,第二年伦奇又提出在酸碱滴定中使用甲基橙。
到了1893 年,有论文记载的合成指示剂已经增加到了十四种之多,随着这些合成剂的数量和品种的增加,以及它们所具备的各种各样的功能,为进一步扩大指示剂的应用范围和发展其理论打下了良好的基础。只需要使用很少量的植物浆汁,就能使颜色的变化非常显著。
可见溶液的颜色是在从pH=pKHIn - 1到 pH=pKHIn + 1的范围内变化的,这个范围称为指示剂的变色范围即变色域。在变色范围内,当溶液的pH值改变时,碱色成分和酸色成分的比值随之改变,指示剂的颜色也发生改变。超出这个范围,如pH≥pKHIn + 1时,看到的只是碱色;而在pH≤pKHIn - 1时,则看到的只是酸色。因此指示剂的变色范围约2个pH单位。由于人的视觉对各种颜色的敏感程度不同,加上在变色域内指示剂呈现混合色,两种颜色互相影响观察,所以实际观察结果与理论值有差别,大多数指示剂的变色范围小于2个pH单位。
指示剂用量过多,还会影响变色的敏锐性。例如:以甲基橙为指示剂,用HCl滴定NaOH溶液,终点为橙色,若甲基橙用量过多则终点敏锐性就较差。
酸碱指示剂
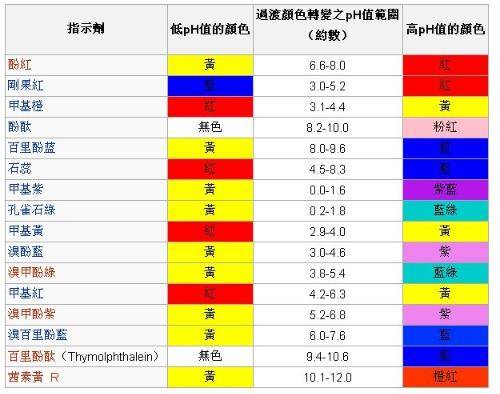
各种指示剂的配制方法和颜色变化及变色pH范围如下 :
百里酚蓝0.1%:是将0.1g指示剂与4.3mL 0.05mol/LNaOH一起研匀,加水稀释成100mL,颜色变化为红-黄、黄-蓝,变色pH范围1.2-2.8、8.0-9.6。
甲基橙0.1%:是将0.1g甲基橙溶于100mL热水,颜色变化为红-黄,变色pH范围3.1-4.4。
溴酚蓝0.1%:是将0.1g溴酚蓝与3mL 0.05mol/L NaOH 溶液一起研磨均匀,加水稀释成100mL,颜色变化为黄-紫蓝,变色pH范围3.0-4.6。
溴甲酚0.1%:是将0.01g指示剂与21mL0.05mol/L NaOH溶液一起研匀,加水稀释成100mL,颜色变化为黄-蓝,变色pH范围3.8-5.4。
甲基红0.1%:是将0.1g甲基红溶于60mL乙醇中,加水至100mL,颜色变化为红-黄,变色pH范围为4.8-6.0。
中性红0.1%:是将中性红溶于乙醇中,加水至100mL,颜色变化为红-黄橙,变色pH范围6.8-8.0。
酚酞1%:是将1g酚酞溶于90mL乙醇中,加水至100mL,颜色变化为无色-淡红,变色pH范围8.2-10.0。
百里酚酞0.1%:是将0.1g指示剂溶于90mL乙醇中加水至100mL,颜色变化为无色-蓝色,变色pH范围9.4-10.6。
茜素黄0.1%混合指示剂:将0.1g茜素黄溶于100mL水中,颜色变化为黄-紫,变色pH范围10.1-12.1。
甲基红-溴甲酚绿:是将3份0.1%溴甲酚绿乙醇溶液与1份0.1%甲基红乙醇溶液混合,颜色变化为红-绿,变色pH范围5.1。
百里酚酞-茜素黄R:是将0.1g茜素黄和0.2g百里酚酞溶于100mL乙醇中,颜色变化为黄-紫,变色pH范围10.2。
甲酚红-百里酚蓝:是将1份0.1%甲酚红钠盐水溶液与3份0.1%百里酚蓝钠盐水溶液,颜色变化为黄-紫,变色pH范围为8.3。
甲基黄0.1:是将0.1g指示剂溶于100mL90%乙醇中,颜色变化为红-黄,变色pH范围为2.9-4.0。
苯酚红0.1:是将0.1g苯酚红溶于100mL60%乙醇中,颜色变化为黄-红,变色pH范围为6.8-8.4。
金属指示剂
名称 | 颜色变化 | 配制方法 |
铬黑T(EBT) | 紫红-蓝-橙 | 与NaCl 1:100 |
二甲酚橙(XO) | 黄-红 | 0.5%乙醇或水溶液 |
K-B指示剂 | 红-蓝-酒红 | 0.2酸性铬蓝K和0.2萘酚绿B溶于水 |
钙指示剂 | 酒红-蓝-酒红 | 5%乙醇溶液 |
吡啶偶氮萘酚(PAN) | 黄绿-黄-淡红 | 1%乙醇溶液 |
磺基水杨酸 | 红紫-无色-黄 | 10%水溶液 |
酸性铬蓝K | 红-蓝 | 0.1%乙醇溶液 |
PAR | 红-黄 | 0.05%或0.2%水溶液 |
钙镁试剂 | 红-蓝-红橙 | 0.05%水溶液 |
天然pH剂
糖萝卜、蓝莓胡萝卜、樱桃咖哩粉、飞燕草花瓣、天竺葵花瓣、葡萄七叶树的叶、绣球花、洋葱牵牛花花瓣、欧洲樱草罂粟花瓣、紫牡丹、红叶卷心菜、红萝卜、大黄玫瑰花瓣、草莓茶百里香、姜黄郁金香花瓣、紫萝兰花瓣、紫色高丽菜汁等。
生物指示剂
生物指示剂是一类特殊的活微生物制品,可用于确认灭菌设备的性能,灭菌程序的验证,生产过程灭菌效果的监控等 .
定义
对特定灭菌处理有确定的抗力,并装在内层包装中可供使用的染菌载体。用于确认灭菌设备的性能,灭菌程序的验证,生产过程灭菌效果的监控等。
分类
1、按结构分可分为片状生物指示剂和自含式生物指示剂。
2、按监测灭菌工艺可分为环氧乙烷灭菌生物指示剂,湿热灭菌生物指示剂,辐照灭菌生物指示剂,干热灭菌生物指示剂,过氧化氢灭菌生物指示剂等;
3、按培养时间可分为通用型生物指示剂和快速型生物指示剂。
二苯偕肼指示液:取二苯偕肼1g,加乙醇100mL使溶解,即得。
双硫腙指示液:取双硫腙50mg,加乙醇100mL使溶解,即得。
石蕊指示液:取石蕊粉末10g,加乙醇40mL,回流煮沸1小时,静置,倾去上层清液,再用同一方法处理二次,每次用乙醇30mL,残渣用水10mL洗涤,倾去洗液,再加水50mL,煮沸,放冷,滤过,即得。变色范围pH4.5~8.0(红→蓝)。
甲酚红指示液:取甲酚红0.1g,加0.05mol/L氢氧化钠溶液5.3mL使溶解,再加水稀释至100mL,即得。变色范围 pH7.2~8.8(黄→红)
甲酚红-麝香草酚蓝混合指示液:取甲酚红指示液1份与0.1%麝香草酚蓝溶液3份,混合,即得。
甲基红指示液:取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4mL使溶解,再加水稀释至200mL,即得。变色范围 pH4.2~6.3(红→黄)。
甲基红-亚甲蓝混合指示液:取0.1%甲基红的乙醇溶液20mL,加0.2%亚甲蓝溶液8mL,摇匀,即得。
甲基红-溴甲酚绿混合指示液:取0.1%甲基红的乙醇溶液20mL,加0.2%溴甲酚绿的乙醇溶液30mL,摇匀,即得。
甲基橙指示液取:甲基橙0.1g,加水100mL使溶解,即得。 变色范围 pH3.2~4.4(红→黄)。
甲基橙-二甲苯蓝FF混合指示液:取甲基橙与二甲苯蓝FF各0.1g,加乙醇100mL使溶解,即得。
邻二氮菲指示液:取硫酸亚铁0.5g,加水100mL使溶解,加硫酸2滴与邻二氮菲0.5g,摇匀,即得。本液应临用新制。
茜素磺酸钠指示液:取茜素磺酸钠0.1g,加水100mL使溶解,即得。变色范围 pH3.7~5.2(黄→紫)
荧光黄指示液:取荧光黄0.1g,加乙醇100mL使溶解,即得。
钙黄绿素指示剂:取钙黄绿素0.1g,加氯化钾10g,研磨均匀,即得。
钙紫红素指示剂:取钙紫红素0.1g,加无水硫酸钠10g,研磨均匀,即得。
姜黄指示液:取姜黄粉末20g,用冷水浸渍4次,每次100mL,除去水溶性物质后,残渣在100℃干燥,加乙醇100mL,浸渍数日,滤过,即得。
结晶紫指示液:取结晶紫0.5g,加冰醋酸100mL使溶解,即得。
酚酞指示液:取酚酞1g,加乙醇100mL使溶解,即得。 变色范围pH8.3~10.0(无色→红)。
铬黑T指示剂:取铬黑T 0.1g,加氯化钠10g,研磨均匀,即得。
淀粉指示液:取可溶性淀粉0.5g,加水5mL搅匀后,缓缓倾入100mL沸水中,随加随搅拌,继续煮沸2分钟,放冷,倾取上层清液,即得。本液应临用新制。
硫酸铁铵指示液:取硫酸铁铵8g,加水100mL使溶解,即得。
溴酚蓝指示液:取溴酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.0mL使溶解,再加水稀释至200mL,即得。 变色范围 pH2.8~4.6(黄→蓝绿)。
溴麝香草酚蓝指示液取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.2mL使溶解,再加水稀释至200mL,即得。 变色范围 pH6.0~7.6(黄→蓝)。
麝香草酚酞指示液:取麝香草酚酞0.1g,加乙醇100mL使溶解,即得。变色范围 pH9.3~10.5(无色→蓝)。
麝香草酚蓝指示液:取麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液4.3mL使溶解,再加水稀释至200mL,即得。变色范围 pH1.2~2.8(红→黄);pH8.0~9.6(黄→紫蓝)。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。