-
碱性 编辑
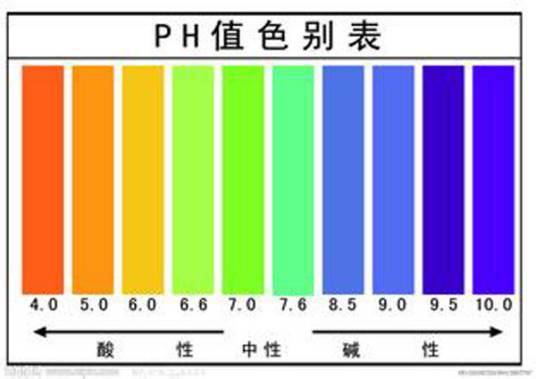
碱性,是指一种物质在溶剂中接收质子的能力,常温时,其pH>7,则溶液呈碱性。
一般来说,物质的碱性强弱取决于接受质子能力的大小和形成的原子团的稳定性等,如NH3能接受BF3形成BF3+NH3-,但该离子的稳定性差,故NH3表现为弱碱性。而NH2-接受H+则形成稳定的NH3,故NH2-表现为强碱性,在水溶液中,NaOH与KOH等碱性相当,这时称这样的溶剂为拉平溶剂,而在某些溶剂中能表现出不同碱碱性的差别,这样的溶剂称为区分溶剂。
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
某些化合物的碱性也可以用O2-负离子的含量来表示,如某些工业用渣的碱性大小用O2-负离子的活度来表示。
非可溶性碱的性质
能与酸反应,例如:Cu(OH)2+2HCI=CuCl2+2H2O。
可溶性碱的通性
1、碱呈碱性
碱能使紫色石蕊试液变蓝
碱能使无色的酚酞试剂变红
2、与酸性氧化物反应
碱 +酸性氧化物
例:① Ca(OH)2+CO2 = CaCO3↓ + H2O
② 2NaOH + CO2 = Na2CO3 + H2O
注:酸性氧化物不等于非金属氧化物。
3、碱与酸发生中和反应
例:① 2NaOH + H2SO4 = Na2SO4 + 2H2O
② Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
4、碱 +盐
例如:Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
条件:① 满足复分解反应的条件(生成物中有沉淀、气体生成或水)
② 反应物必须可溶于水
如CaCO3 + Ba(OH)2
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。