-
偶极矩 编辑
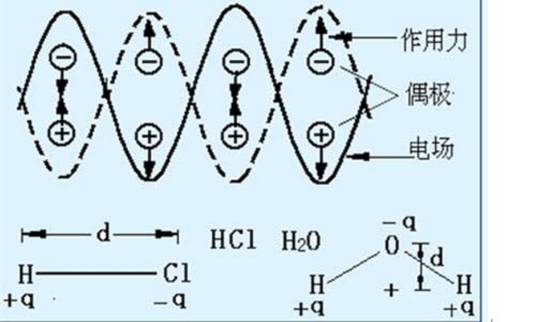
偶极矩(dipolemoment)是正、负电荷中心间的距离和电荷中心所带电量的乘积,它是一个矢量,方向规定为从正电中心指向负电中心,用符号μ表示,单位为D(德拜)。偶极矩的数学表达式为μ=qd。根据讨论的对象不同,偶极矩可以指键偶极矩,也可以是分子偶极矩。分子偶极矩可由键偶极矩经矢量加法后得到。实验测得的偶极矩可以用来判断分子的空间构型。偶极矩的SI单位是C·m(库仑·米)。但传统上用于度量化学键的偶极矩的单位是德拜,符号D。这是由于电子电荷e=1.6022×10-19C,而键偶极矩的电量q的数量级为10-10esu,esu是静电单位的符号,1esu=3.335×10-10C,键偶极矩的长度l的数量级为10-8,两者相乘的数量级为10-18esu·cm,因而得到化学键的偶极矩单位——德拜,1D=10-18esu·cm。
中文名:偶极矩
外文名:dipole moment
表达式:μ=qd
适用领域:电学、电介质物理学、结构化学
应用学科:物理学、化学
常见参数
常见键的偶极矩数值(μ/10-30C·m)。
C—N | C—O | C—F | C—Cl | C—Br | C—I |
1.34 | 2.87 | 5.04 | 5.21 | 4.94 | 4.31 |
H—C | H—N | H—O | C═N | C═O | C≡N |
1.00 | 4.38 | 5.11 | 4.67 | 8.02 | 12.02 |
测量方法
溶液法是测量偶极矩的一种简便易行的方法,它利用了稀溶液的电容、密度、和折射率与溶质摩尔分数的线形关系。实验中通过测量宏观实际量来推算出理想状态下无穷量,测出某一温度下溶液和纯溶剂的这三个物理量,就可以得到溶质分子的偶极矩。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。