-
水合氢离子 编辑
水合氢离子指的是氢离子被水分子吸引生成的物质,通常用H3O+表示。所以水的电离可以用以下方程式表示2H2O=H3O++OH-。水合氢离子是最简单的氧鎓(钅羊)(Oxonium)。氢原子在失去电子后,剩余由1个质子构成的核,即氢离子,氢离子是“裸露”的质子,半径很小,易被水分子吸引生成水合氢离子。
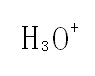 水合氢离子
水合氢离子
 水合氢离子
水合氢离子
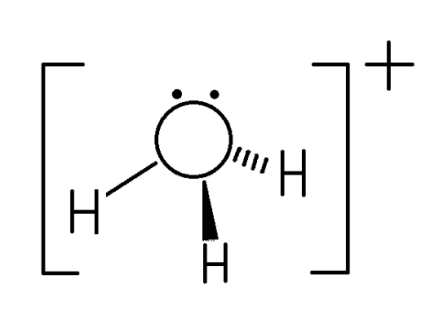
水合氢离子是H3O+中,就是有一个H+与空余的2px轨道中的电子对成键所构成的(这里面氢核周围没有电子,氧把两个电子都给H,形成配位键),但不改变原来的sp3杂化。
实际上,水合氢离子在稀酸中进一步水合,以H9O4+(即H3O+·3H2O) 形式存在,即三个H2O的氧原子分别与H3O+中的三个氢形成氢键。
例如,盐酸的电离常数为107,在室温下与水的混合物是液态的。而高氯酸的电离常数为1010,如果液体无水高氯酸和水以1:1的摩尔比结合,则反应形成固体一水合高氯酸,即高氯酸的水合氢离子盐:
H2O+HClO4=H3O+·ClO4-
也有很多的含有水合的H3O+的例子,例如HCl·2H2O中含有H5O2+(H3O+·H2O),HBr·4H2O中含有H7O3+(H3O+·2H2O)和H9O4+(H3O+·3H2O)
 配位键形式
配位键形式
 球棍模型
球棍模型
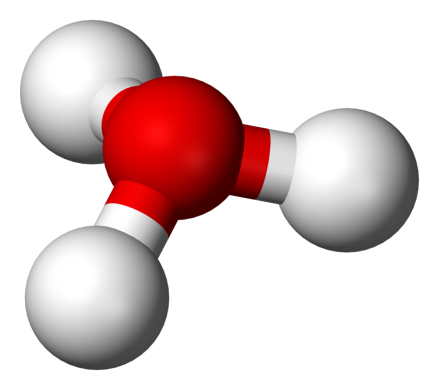
由于O+和N原子具有相同的电子数,因此H3O+与NH3的电子数相等,从H3O+的球棍模型可以看出,其具有氧原子位于顶点的三角锥形分子构型,H-O-H的夹角大约为113o,同时质心非常靠近氧原子 。因为金字塔的底部是由三个相同的氢原子组成的,H3O+分子的对称顶部结构属于C3v点群。因为这个对称和它有偶极矩的事实,旋转选择规则是ΔJ=±1 和ΔK=0。过渡偶极子在c轴上,由于负电荷在氧原子附近,因此偶极矩指向顶点,垂直于基面。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。






























