-
配位数 编辑
配位数,配位化学中是指化合物中中心原子周围的配位原子个数,此概念首先由阿尔弗雷德·维尔纳在1893年提出。配位数通常为2-8,也有高达10以上的,如铀和钍的双齿簇状硝酸根离子U(NO3)6、Th(NO3)6,及研究的PbHe15离子,该离子中铅的配位数至少为15。配位数(coordination number)是中心离子的重要特征。直接同中心离子(或原子)配位的离子数目叫中心离子(或原子)的配位数。
 配位数
配位数
此概念也可延伸至任何化合物,也就是配位数等同于共价键键连数,例如,可以说甲烷中碳的配位数为4。这种说法通常不计π键。
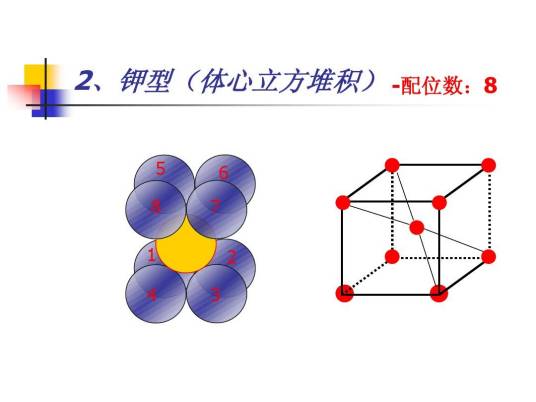
晶体学中,配位数是晶格中与某一布拉维晶格相距最近的格子个数。配位数与晶体结构或晶胞类型有关,且决定原子堆积的紧密程度,体心立方晶系中原子配位数为8。最高的配位数(面心立方)为12,存在于六方紧密堆积和立方紧密堆积结构中。
离子晶体中,指一个离子周围最近的异电性离子的数目。
周期数
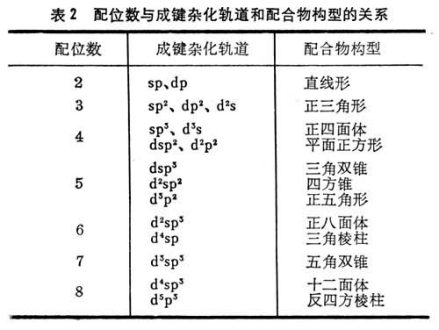
中心原子的最高配位数决定于它在周期表中的周次。在周期表内,第1周期元素的最高配位数为2,第2周期元素的最高配位数为4,第3周期为6,以下为8、10。最高配位数是指在配合物中,中心原子周围的最高配位原子数,实际上一般可低于最高数。由表可见,在实际中第1周期元素原子的配位数为2,第2周期不超过4。除个别例外,第3、4周期不超过6,第5、6周期为8。最常见的配位数为4和6,其次为2、5、8。配位数为奇数的通常不如偶数的普遍。
电荷
 配位数
配位数
成键轨道
从价键理论的观点来说,中心原子成键轨道的性质决定配位数,而中心原子的电子构型对参与成键的杂化轨道的形成很重要,例如,Zn2+和Cu+离子的5个3d轨道是全满的,适合成键的是一个4s和3个4p轨道,经sp3杂化形成4个成键轨道,指向正四面体的四个角。因此,Zn2+和Cu2+与CN-生成配位数为4的配离子2-和3-,并且是正四面体构型(表2)。
配体性质
同一氧化态的金属离子的配位数不是固定不变的,还取决于配体的性质。例如,Fe3+与Cl-生成配位数为 4的-,而与F-则生成配位数为 6的3-。这是因为 Fe3+从每个体积较大而较易极化的Cl-接受的电荷要大于体积较小而较难极化的F-。配合物的中心原子与配体间键合的性质,对决定配位数也很重要。在含F-的配合物中,中心原子与电负性很高的F-间的键合主要是离子键。如在B3+、Fe3+和Zr4+与F-的配合物中,随着中心原子半径的增加,配位数分别为4、6和7,主要受中心原子与配体的半径比的限制(表3)。很多配合物的中心原子与配体(例如CN-、NO、SCN-、Br-、I-、NH3和CO等)间主要形成共价键,它们的配位数决定于中心原子成键轨道的性质。
配位场理论认为中心原子的内层轨道受周围配体的影响,也即关系到配位数。例如,Ni2+离子与H2O和NH3等具有小的相互排斥力的弱场配体,生成配位数为 6的2+和2+等八面体配离子;与Br-和I-等具有大的相互排斥力的弱场配体则趋向于生成配位数为4的2-和2-等正四面体配离子;与CN-等强场配体则生成配位数为4的2-平面正方形配离子。
举例介绍
中心离子(或原子)同单基配体结合的数目就是该中心离子(或原子)的配位数。例如SO4中Cu离子的配位数为4,Cl中Co离子的配位数为6。中心离子(或原子)同多基配体配合时,配位数等同于配位原子数目,例如中的乙二胺(en)是双基配体,因此Cu离子的配位数为4。
中心离子的配位数一般是2、4、6,最常见的是4和6,配位数的多少取决于中心离子和配体的性质──电荷、体积、电子层结构以及配合物形成时的条件,特别是浓度和温度。一般来讲,中心离子的电荷越高越有利于形成配位数较高的配合物。如Ag,其特征配位数为2,如;Cu,其特征配位数为4,例;Co,其特征配位数为6,例。但配体电荷的增加对形成高配位数是不利的,因为它增加了配体之间的斥力,使配位数减少。如同相比,前者的配体是中性分子,后者是带负电荷的Cl离子,使Co的配位数由6降为4。因此,从电荷这一因素考虑,中心离子电荷的增高以及配位体电荷的减少有利于配位数的增加。
中心离子的半径越大,在引力允许的条件下,其周围可容纳的配体越多,配位数也就越大。例如Al与F可形成配离子,体积较小的B(Ⅲ)原子就只能生成配离子。但应指出中心离子半径的增大固然有利于形成高配位数的配合物,但若过大又会减弱它同配体的结合,有时反而降低了配位数。如Cd可形成配离子,比Cd大的Hg,却只能形成配离子。显然配位体的半径较大,在中心离子周围容纳不下过多的配体,配位数就减少。如F可与Al形成配离子,但半径比F大的Cl、Br、I与Al只能形成配离子(X代表Cl、Br、I离子)。
温度升高,常使配位数减小。这是因为热振动加剧时,中心离子与配体间的配位键减弱的缘故。而配位体浓度增大有利于形成高配位数的配合物。
综上所述,影响配位数的因素是复杂的,是由多方面因素决定的,但对于某一中心离子在与不同的配体结合时,常具有一定的特征配位数。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。