-
氯气 编辑
氯气(chlorine)是氯元素形成的一种单质,化学式Cl2。常温常压下为黄绿色,有强烈刺激性气味的剧毒气体,具有窒息性,密度比空气大。熔点-101.00℃,沸点-34℃。可溶于水和碱溶液,易溶于有机溶剂,难溶于饱和食盐水。易压缩,可液化为黄绿色的油状液氯。氯气中混合体积分数为5%以上的氢气时遇强光可能会有爆炸的危险。氯气具有毒性,主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,会对上呼吸道黏膜造成损害。氯气是氯碱工业的主要产品之一,能与有机物和无机物进行取代反应和加成反应生成多种氯化物,也可用作为强氧化剂。主要用于生产塑料(如PVC)、合成纤维、染料、农药、消毒剂、漂白剂以及各种氯化物。自然界中的氯多以Cl-离子的形式存在于矿物或海水中,也有少数氯以游离态存在于大气层中,不过此时的氯气受紫外线经常会分解成两个氯原子(自由基),氯气也是破坏臭氧层的主要单质之一。氯气被列入《危险化学品名录》 ,并按照《危险化学品安全管理条例》管控。
中文名:氯气
外文名:ChlorineDichlorine
化学式:Cl2
分子量:70.90
CAS登录号:7782-50-5
EINECS登录号:231-959-5
熔点:-101 ℃(101 kpa)
沸点:-34 ℃(101 kpa)
水溶性:1体积水在常温下可溶解2体积氯气
密度:3.21 kg/m³(101kpa, 20℃)
外观:常温常压下为有强烈刺激性气味的黄绿色气体
应用:杀菌、消毒、漂白
安全性描述:S9;S45;S61
危险性符号:T+;C
危险性描述:R23;R50;R36/37/38
UN危险货物编号:1017
CN危险货物编号:23002
氯气的发现
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,他发现这是一种新的气体,并具有刺激性。
舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属或金属氧化物发生化学反应。从1774年舍勒发现氯气以后,到1810年,许多科学家先后对这种气体的性质进行了研究。这期间,氯气一直被当作一种化合物。直到1810年,戴维经过大量实验研究,才确认这种气体是由一种化学元素组成的物质。他将这种元素命名为chlorine,这个名称来自希腊文,有“绿色的”意思。中国早年的译文将其译作“绿气”,后改为氯气。
技术发展史
氯气的生产方法经历了漫长的发展过程。1774年,瑞典化学家舍勒用软锰矿(含有二氧化锰)和浓盐酸作用,首先制得了氯气,其反应方程式为:
然而,由于当时还不能够大量制得盐酸,故这种方法只限于实验室内制取氯气。后来,法国化学家贝托雷把氯化钠、软锰矿和浓硫酸的混合物装入铅蒸馏器中,经过加热制得了氯气,其反应方程式为:
因为此法原料易得,所以,自1774年舍勒制得氯气到1836年止,人们一直沿用贝托雷发明的方法来生产氯气。
1836年,古萨格发明了一种焦化塔,用来吸收路布蓝法生产纯碱(Na2CO3)的过程中排出的氯化氢气体(以前这种含氯化氢的气体被认为是一种废气,从古萨格开始,才得到了充分利用)得到盐酸,从此盐酸才成为一种比较便宜的酸,可以广为利用.舍勒发明的生产氯气的方法,经过改进,到此时才成为大规模生产氯气的方法。
1868年,狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧气来氧化氯化氢气体制取氯气的方法,其反应方程式为:
这种方法被称为狄肯法(地康法)。
上面这些生产氯气的方法,虽然在历史上都起过一定的作用,但是它们与电解法生产氯气相比,无论从经济效益还是从生产规模上,都大为逊色.当电解法在生产上付诸实用时,上述生产氯气的方法就逐渐被淘汰了。
电解法的诞生要追溯到1833年。法拉第经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,能够获得氯气,其反应方程式为:
后来,英国科学家瓦特也发现了这种方法,并在1851年获得了一份关于生产氯气的英国专利。但是由于当时没有实用的直流发电机以产生足够的电流,所以电解法也只能停留在实验室规模,不能付诸工业生产,而被束之高阁。一直到十九世纪七十至八十年代,出现了比较好的直流发电机,电解法才得到广泛的应用。从此,氯气的工业生产跨入了一个新纪元。然而当时电解制取氯气所使用的电极为汞,致使电解得到的氯气、氢气中混有相当多的汞蒸气。这种“汞法制氯”对环境危害很大,所以新的“离子交换膜法”制取氯气,更环保,更节能。(汞法制氯是制取氯气的主流方法,如2010年中国有46%的氯气,2000年西欧50.1%的氯气都为此法生产的)。%20
物理性质
1.性状:黄绿色、有刺激性气味的气体。
2.熔点(℃):-101(101%20kpa)
3.沸点(℃):-34.0(101%20kpa)
4.相对密度(水=1):1.41(101%20kpa,%2020℃)%20
5.相对蒸气密度(空气=1):2.5
6.饱和蒸气压(kPa):673(20℃)
7.临界温度(℃):144
8.临界压力(MPa):7.71
9.辛醇/水分配系数:0.85%20
10.溶解性:1体积水在常温下可溶解2体积氯气。%20
物质结构
1.原子结构:氯原子最外层有7个电子,反应中易得到1个电子或共用一个电子对达到稳定结构(共价键)。
3.摩尔折射率:11.74
4.摩尔体积(cm3/mol):51.3
5.等张比容(90.2 K):109.0
6.表面张力(dyne/cm):20.4
7.极化率(10-24 cm3):4.65
8.单一同位素质量:69.937705 Da
9.标称质量:70 Da
10.平均质量:70.906 Da
化学性质
漂白性
氯气与水反应:Cl2 + H2O = HCl + HClO
氯气能与水发生歧化反应生成盐酸和次氯酸,而次氯酸具有强氧化性,具有漂白性,同时也有消毒作用。
助燃性
氯气支持燃烧,许多物质都可在氯气中燃烧(除少数物质如木炭等)。
与金属反应
1.与钠的反应:2Na + Cl2 = 2NaCl
 钠在氯气中燃烧
钠在氯气中燃烧
2.与铜的反应:Cu + Cl2 = CuCl2
 铜在氯气中燃烧
铜在氯气中燃烧
3.与铁的反应:2Fe + 3Cl2 = 2FeCl3
 铁在氯气中燃烧
铁在氯气中燃烧
4.与镁的反应:Mg + Cl2 = MgCl2
 镁在氯气中燃烧
镁在氯气中燃烧
注:氯气具有强氧化性,加热下可以与多数金属反应,如金、铂在热氯气中燃烧,而与Fe、Cu等变价金属反应则生成高价金属氯化物。
常温下,干燥氯气或液氯不与铁反应,只能在加热情况下反应,所以可用钢瓶储存氯气(液氯)。
与非金属单质反应
1.与氢气的反应:
现象:H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口处出现白雾。
注:将点燃的氢气放入氯气中,氢气只在管口与少量的氯气接触,产生少量的热;点燃氢气与氯气的混合气体时,大量氢气与氯气接触,迅速化合放出大量热,使气体急剧膨胀而发生爆炸。工业上制盐酸使氯气在氢气中燃烧。氢气在氯气中爆炸极限是9.8%~52.8%。
现象:产生白色烟雾
3.与硫的反应:
注:在一定条件下,氯气还可与S、Si等非金属直接化合。
与无机化合物反应
1.与二氧化硫和水反应:
SO2%20+%20Cl2%20+%202H2O%20=%20H2SO4%20+%202HCl
2.与碱溶液反应:
Cl2%20+%202NaOH%20=%20NaCl%20+%20NaClO%20+%20H2O
2Cl2%20+%202Ca(OH)2%20=%20CaCl2%20+%20Ca(ClO)2%20+%202H2O
注:上述两反应中,Cl2同时作氧化剂和还原剂,是歧化反应。
3.与盐溶液反应:
Cl2%20+%202FeCl2%20=%202FeCl3
Cl2%20+%20Na2S%20=%202NaCl%20+%20S↓
Cl2%20+%202I-%20=%202Cl-%20+%20I2↓
Cl2%20+%202Br-%20=%202Cl-%20+%20Br2
注:中学阶段用来证明氯气非金属性和氧化性比硫强。
4.与二硫化碳反应:
CS2%20+%203Cl2%20→%20CCl4%20+%20S2Cl2
注:反应条件为90℃到100℃。%20
与有机化合物反应
1.与甲烷的反应:
现象:黄绿色气体消失,容器内壁出现液珠,容器内压强下降。氯气与甲烷反应时,四个反应同时进行。
2.与乙烯的反应:
CH2=CH2%20+%20Cl2%20→%20CH2ClCH2Cl(1,2-二氯乙烷)(加成反应)%20
3.与苯的反应:
注:该取代反应在氯化铁的催化下才能发生。
4.与环丙烷的开环反应
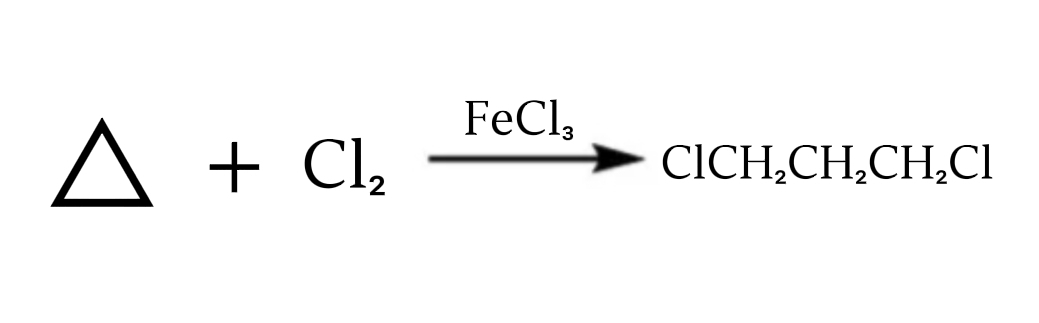 氯气与环丙烷的开环反应
氯气与环丙烷的开环反应
环丙烷在三氯化铁存在时与氯气反应,生成1,3-二氯丙烷
2.装置如图:在烧瓶1中放10gKMnO4粉末,由末端带弯管的图氯气制备装置。1—浮兹烧瓶;2—滴液漏斗;3—装有浓H2SO4的瓶子;4—移液管;5—排气管;6—反应器滴液漏斗2滴加60~65mL盐酸(相对密度1.17),可以逸出均匀的氯气流。如果需要在压力下向反应器中通入氯气,可用调节装置。将烧瓶与一装有浓H2SO4的瓶3相连,于瓶塞的一孔插入可自由移动的移液管4,并与通至通风橱的管5相连。当移液管自硫酸中提出时,气体则进入通风橱中。当移液管浸入酸中时,氯气即进入反应器中,只是当相应于移液管位置的酸柱不能平衡气体的压力时,氯气才能进入通风橱中。与此法类似,用来氧化盐酸的氧化剂还可以用MnO2或K2Cr2O7。
3.大量氯气(或经常制取少量氯气)可利用漂白粉与盐酸的反应。在启普发生器的中间球内放入漂白粉小块,并加入盐酸(相对密度1.12)为了提纯释出的氯气可使其通过盛有水和浓H2SO4的洗瓶。漂白粉块可用新鲜漂白粉压制而成。若长时间停止操作最好将盐酸从发生器中倒出。因为盐酸会溶解氯而逐渐充满中间球部,又会开始发生氯气。钢瓶装的工业品氯含有少量O2、N2、HCl、H2O等杂质。为提纯,首先使氯气通过两个浓H2SO4洗瓶,然后通过CaO柱(除去HCl)和P2O5管,为除去O2和N2须将气体液化,即将其在已经用干冰和丙酮的混合物冷却到-78℃的接受器中冷凝。未冷凝的气体主要是氧用泵抽出。然后将氯蒸发并重新冷凝,重复操作数次后,再在真空及液化空气温度下进行分馏,收集中间馏分,即得纯净氯气。
化学工业
化学工业用于生产次氯酸钠、氯化铝、三氯化铁、漂白粉、溴素、三氯化磷等无机化工产品,还用于生产有机氯化物,如氯乙酸、环氧氯丙烷、一氯代苯等。也用于生产氯丁橡胶、塑料及增塑剂。日用化学工业用于生产合成洗涤剂原料烷基磺酸钠和烷基苯磺酸钠等。
制环氧丙烷
在氯醇法生产环氧丙烷的过程中,有一步反应是丙烯与次氯酸反应生成氯醇,因此可将氯水用于氯醇化反应中,同时氯水可部分代替生产所用工艺水。
反应方程式如下:
Cl2 + H2O = HCIO + HCl;
C3H6 + HCIO = C3H7ClO。
C3H7ClO + Ca(OH)2 = C3H6O + CaCl2 + 2H2O。
制备氯化铁
此方法利用工业盐酸或酸洗废液与废铁屑反应,生成氯化亚铁溶液,氯化亚铁溶液与废铁屑组成的循环吸收液与氯气发生氧化还原反应,氯气将Fe2+氧化为Fe3+,Fe3+被吸收液中的铁屑还原为Fe2+,Fe2+继续与氯气反应,形成循环吸收。
涉及应方程式有:
Fe + 2H+ = Fe2+ + H2↑;
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-;
2Fe3+ + Fe = 3Fe2+。
制盐酸
工业上制取盐酸时,首先在反应器中将氢气点燃,然后通入氯气进行反应,制得氯化氢气体,反应方程式为:
H2 + Cl2 = 2HCl
氯化氢气体冷却后被水吸收成为盐酸。在氯气和氢气的反应过程中,有毒的氯气被过量的氢气所包围,使氯气得到充分反应,防止了对空气的污染。
制聚氯乙烯
重单体制法可分为两种路线,一种是以乙烯为原料的石油路线,即氧氯化法。由石油裂解分离出乙烯,然后用氧气和HCl(裂解副产物)作用生成的Cl2与乙烯发生氯化反应,生成二氯乙烷,再裂解出氯化氢得氯乙烯。
其总反应方程式为:
4CH2=CH2 + O2 + 2Cl2 → 4CH2=CHCl + 2H2O
另一种为乙炔电石法。以电石为原料制备乙炔,然后与氯化氢反应制得氯乙烯。
反应方程式为:
CaC2 + 2H2O → 4CHCH + Ca(OH)2;
CHCH + HCl → CH2=CHCl(反应条件为 HgCl2/C 120-180℃)。
制漂白物
氯气制成的漂白物很多,一般生活中涉及两种,NaClO和Ca(ClO)2。一般来说,消毒液是NaClO,一般用氯气通入氢氧化钠中制得。但其价格较高,工业漂白不用,常见于84消毒液。消毒粉则是Ca(ClO)2,因为其不够稳定一般为固体,是氯气通入石灰乳中制得,价格低廉,用于工业漂白,使用方法是加水溶解有效成分是次氯酸钙,从而漂白(制备次氯酸钙固体,用氢氧化钠溶液吸收含氯尾气得到的产物是次氯酸钠溶液,得不到固体产物,不容易长时间保存。用氢氧化钠和氢氧化钙的混合水溶液吸收氯气时,能够得到次氯酸钙固体,便于储存和使用)。保存以上漂白剂时,注意密封干燥,避免阳光直射。因为次氯酸盐在空气中会与二氧化碳、水发生反应,产生次氯酸,次氯酸在光照下分解,从而导致漂白剂失效。
冶金工业
主要用于生产金属钛、镁等。
电子工业
在电子工业中,高纯氯气主要用于电子工业干刻、光导纤维、晶体生长和热氧化。
干法蚀刻
干法刻蚀是用等离子体进行薄膜刻蚀的技术。
干刻又叫干法蚀刻,是指气固反应,气相产物主要有GaCl2,AsCl2和氢气,使用氯气做等离子蚀刻时,通常采用5%的高纯氯气+95%的氦气。
用氯气氧化降解制备纳米微晶纤维素
中国专利公开了用氯气氧化降解制备纳米微晶纤维素的方法,与水解法制备纳米微晶纤维素相比,氯气氧化降解法利用了氯气水解所产生的次氯酸钠的漂白作用,可以使制得的纳米微晶纤维素光亮、洁白。
氯气还用于大规模集成电路、光纤、高温超导等技术领域。
医药工业
氯气常用于制药,常参与含氯有机化合物的合成。如:马来酸氨氯地平片;N-(2-甲基-2,3-二氢-1H-吲哚基)-3-氨磺酰基-4-氯-苯甲酰胺。
农药工业
用作生产高效杀虫剂、杀菌剂、除草剂、植物生长刺激剂的原料。如:敌百虫、敌敌畏等。
其他方面
用于啤酒厂的污水处理
中国专利公布了用氯气对啤酒厂污水进行处理的方法。氯气价格低廉,用量少,消毒可靠,工艺成熟,是自来水公司普遍使用的消毒剂,氯气还可以除臭、除微生物,对生物耗氧量和化学耗氧量去除率也很高,可确保回收水质的稳定,因而比较适合啤酒厂污水的处理。
自来水消毒
自来水常用氯气消毒,1 L水里约通入0.002 g氯气,消毒原理是其与水反应生成了次氯酸,它的强氧化性能杀死水里的病菌。而之所以不直接用次氯酸为自来水杀菌消毒,是因为次氯酸易分解难保存、成本高、毒性较大,则用氯气消毒可使水中次氯酸的溶解、分解、合成达到平衡,浓度适宜,水中残余毒性较少。
去除乙炔中的硫、磷杂质
乙炔气是PVC生产的主要原料。工业乙炔气中,硫、磷是以H2S和H3P气体形式存在的,这2种气体超标,会使生产PVC所用的催化剂中毒。利用氯水中的CIO-的强氧化性,对乙炔气进行喷淋洗涤,可除去H2S和H3P。
反应方程式如下:
4ClO- + H2S → H2SO4 + 4Cl-
4ClO- + H3P → H3PO4 + 4Cl-。
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积:0
7.重原子数量:2
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
1、摩尔折射率:11.74
2、摩尔体积(cm3/mol):51.3
3、等张比容(90.2K):109.0
4、表面张力(dyne/cm):20.4
5、介电常数:无可用的
6、极化率(10-24cm3):4.65
7、单一同位素质量:69.937705 Da
8、标称质量:70 Da
9、平均质量:70.906 Da
1.急性毒性 LC50:850 mg/m3(大鼠吸入,1h)
2.亚急性与慢性毒性 家兔吸入2~5 mg/m3,每天5 h,1~9个月,出现消瘦、上呼吸道炎、肺炎、胸膜炎及肺气肿等。大鼠吸入41~97 mg/m3,每天1~2 h,3~4周,引起严重但非致死性的肺气肿与气管病变。
3.致突变性 细胞遗传学分析:人淋巴细胞20 ppm。精子形态学分析:小鼠经口20 mg/kg(5d)(连续)。微生物致突变:鼠伤寒沙门菌1800 μg/L。
4.其他 LCLo:2530 mg/m3(人吸入30 min),500 ppm(人吸入5 min)
中毒机理:
氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成损伤:次氯酸使组织受到强烈的氧化;盐酸刺激黏膜发生炎性肿胀,使呼吸道黏膜浮肿,大量分泌黏液,造成呼吸困难,所以氯气中毒的明显症状是发生剧烈的咳嗽。症状重时,会发生肺水肿,使循环作用困难而致死亡。由食道进入人体的氯气会使人恶心、呕吐、胸口疼痛和腹泻。1L空气中最多可允许含氯气0.001 mg,超过这个量就会引起人体中毒。
临床表现
急性中毒主要为呼吸系统损害的表现。
a、起病及病情变化一般均较迅速。
b、可发生咽喉炎、支气管炎、肺炎或肺水肿,表现为咽痛、呛咳、咳少量痰、气急、胸闷或咳粉红色泡沫痰、呼吸困难等症状,肺部可无明显阳性体征或有干、湿性罗音。有时伴有恶心、呕吐等症状。
c、重症者尚可出现急性呼吸窘迫综合征,有进行性呼吸频速和窘迫、心动过速,顽固性低氧血症,用一般氧疗无效。
d、少数患者有哮喘样发作,出现喘息,肺部有哮喘音。
e、极高浓度时可引起声门痉挛或水肿、支气管痉挛或反射性呼吸中枢抑制而致迅速窒息死亡。
f、病发症主要有肺部继发感染、心肌损害及气胸、纵隔气肿等。
g、X线检查:可无异常,或有两侧肺纹理增强、点状或片状边界模糊阴影或云雾状、蝶翼状阴影。
h、血气分析:病情较重者动脉血氧分压明显降低。
i、心电图检查:中毒后由于缺氧、肺动脉高压以及植物神经功能障碍等,可导致心肌损害及心律失常。
眼损害:氯可引起急性结膜炎,高浓度氯气或液氯可引起眼灼伤。
皮肤损害:液氯或高浓度氯气可引起皮肤暴露部位急性皮炎或灼伤。
浓度(mg/m3)(ppm) | 反应 |
30000(10000) | 一般滤过性防毒面具也无保护作用 |
3000(1000) | 深吸入少许可能危及生命 |
300(100) | 可能造成致命性伤害 |
120-180(40-60) | 接触30-60 min可能引起严重损害 |
90(30) | 引起剧烈咳嗽 |
18(6) | 刺激咽喉 |
3-9(1-3) | 有明显的气味、刺激眼、鼻 |
1.5(0.5) | 略有气味 |
0.06(0.02) | 嗅觉不到浓度 |
吸入气体者立即脱离现场至空气新鲜处,保持安静及保暖。眼或皮肤接触液氯时立即用清水彻底冲洗。
吸入后有症状者至少观察12小时,对症处理。吸入量较多者应卧床休息,吸氧,给舒喘灵气雾剂、喘乐宁(Ventolin)或5%碳酸氢钠加地塞米松等雾化吸入。
急性中毒时需合理氧疗;早期、适量、短程应用肾上腺糖皮质激素;维持呼吸道通畅;防治肺水肿及继发感染。参见《急性刺激性气体中毒性肺水肿的治疗》
其他对症处理。
眼及皮肤灼伤按酸灼伤处理,参见《化学性眼灼伤的治疗》和《化学性皮肤灼伤的治疗》。
泄露处理
氯气发生泄漏后,应采取针对性的应急措施。泄漏污染区人员应迅速撤离至上(侧)风处,并立即设置警戒,小泄漏时,于150米处设置警戒,大泄漏时,于450米设置警戒。消防人员必须佩戴空气呼吸器或氧气呼吸器,穿全身防火防毒服,手戴橡胶手套,在上风向进行处置。尽可能切断泄漏源,合理通风,加速扩散,喷雾状水稀释、溶解,构筑围堤或挖坑收容产生的大量废水。如有可能,用管道将泄漏物导至还原剂(酸式硫酸钠或酸式碳酸钠)溶液中或将漏气钢瓶浸入石灰乳液中。 具体处置措施为:
(一)关阀断源。生产装置发生氯气泄漏,事故单位的工程技术人员或熟悉工艺的人员关闭输送物料的管道阀门,断绝物料供应,切断事故源,公安消防队出开花或喷雾水枪掩护并协助操作。
(二)倒罐转移。储罐、容器壁发生泄漏,无法堵漏时,可采用疏导的方法将液氯倒入其他容器或储罐。
(三)化学中和。储罐、容器壁发生少量泄漏,可采用化学中和的方法,即在消防车水罐中加入生石灰、苏打粉等碱性物质,向罐体、容器喷射,以减轻危害,也可将泄漏的液氯导至碳酸钠溶液中,使其中和,形成无危害或微毒废水。具体反应为CaO+H2O一Ca(OH)2,2Ca(OH)2+2Cl2一CaCl2+Ca(ClO)2+2H2O。生成氯化钙和次氯酸钙,都没有毒害作用。如果现场温度比较高,则生成氯化钙和氯酸钙。产物的沉降度比较好,不会形成悬浮物,很快降落到地面,对地面植物起到钙肥作用。
(四)稀释降毒。以泄漏点为中心,在储罐、容器壁的四周设置水幕或喷雾水枪喷射雾状水进行稀释降毒,但不宜使用直流水或直接对准泄漏点喷射,避免氯气与水作用生成酸,加速对泄漏点的腐蚀。除了使氯气溶解于水外,还可以利用氯气与水的反应加大对空气中氯气的吸收。
(五)浸泡水解。运输途中体积较小的液氯钢瓶阀门损坏,发生泄漏,又无堵漏器具无法制止外泄时,可将钢瓶浸入氢氧化钙等碱性溶液中进行中和,也可将钢瓶浸入水中。
(六)器具堵漏。管道壁发生泄漏,且泄漏点处在阀门以前或阀门损坏,不能够关阀止漏时,可使用不同形状的堵漏垫、堵漏楔、堵漏袋等器具实施封堵。(a)微孔跑冒滴漏可用螺丝钉加粘合剂旋入孔内的方法堵漏。(b)罐壁撕裂发生泄漏,可用充气袋、充气垫等专用器具从外部包裹堵漏。(c)带压管道泄漏,可用捆绑式充气堵漏带或使用金属外壳内衬橡胶垫等专用器具实施内外堵漏。(d)阀门法兰盘或法兰垫片损坏,发生泄漏,可用不同型号的法兰夹具,并注射密封胶的方法进行封堵,也可直接使用专门的阀门堵漏工具实施堵漏。
(七)洗消处理。一是化学消毒法。即用氢氧化钠、氨水、碳酸氢钠等碱性物质溶于水中,喷洒在污染区域或受污染体表面,发生化学反应改变毒物性质,成为无毒或低毒物质;二是物理消毒。即用吸附垫、活性炭等具有吸附能力的物质,吸附回收后转移处理;对染毒空气可用水驱动排烟机吹散降毒,也可对污染区暂时封闭,依靠自然条件如日晒、通风使毒气消失;也可喷射雾状水进行稀释降毒。
危害防治
1.不能选用存在缺陷的设备和部件,各设备和部件要定期检测和检验;
2.加强工艺管理,严格控制工艺指标,发现问题必须及时检查和处理;
3.加强事故氯处理装置的管理和检修,相关装置采用多路电源供电,定期清洗事故氯处理装置,机泵定期试车;
4.为了及时发现氯气泄漏,在生产、储存、输送和使用的岗位都要安装氯气报警器,一旦氯气泄漏,可及早发现,防止事故扩大,并在液化岗位安装电视监控和碱液喷淋装置;
5.加强对职工的安全教育和培训。
 氯气泄漏处理
氯气泄漏处理
①液化尾气中氯气、氢气与空气的混合气爆炸;
②包装容器中残存有机物杂质与氯气反应爆炸;
③水和食盐水溶液中铵盐带入液化系统,会使液氯中三氯化氮积累而引起爆炸。
当液氯蒸发用完后,所用容器均须用水和碱水冲洗,以除去被三氯化氮污染的液氯后,方能修理和使用。氯是剧毒物,生产中对受压容器等设备应严格要求,防止氯气泄漏。空气中氯气允许浓度不大于1 ppm。
中华人民共和国安全生产法;
中华人民共和国职业病防治法;
中华人民共和国环境保护法;
危险化学品安全管理条例;
安全生产许可证条例;
化学品分类和危险性公示 通则(GB 13690-2009);
危险化学品目录(2015版)。
2020年9月4日晚,一辆运输氯气罐的卡车4日晚在伊朗西部伊拉姆省发生爆炸泄漏,造成217人受伤。据报道,这辆卡车在前往伊拉克途中,经停奥利亚村时一个氯气罐发生爆炸。氯气泄漏到空气中,导致大量居民受伤。
2021年4月28日上午7时许,常州市经开区横山桥镇一废弃自来水厂在拆除过程中发生氯气泄漏事件,与事发地仅一河之隔的横山桥中心小学受到影响。该校总务处主任周荣青经历了事发全过程,据其回忆,早上在巡查时发现革新河河水明显发绿,并伴有刺鼻气味。
2022年4月18日晚,美国南部路易斯安那州一家化工厂发生火灾,造成氯气泄漏。据报道,位于路易斯安那州普拉克明地区的奥林化工厂当晚火灾引发氯气泄漏,气味扩散至数公里外,厂区上空一度浓烟滚滚。约50分钟后,大火被扑灭。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。






























