-
酚 编辑
酚类化合物种类繁多,有苯酚、甲酚、氨基酚、硝基酚、萘酚、氯酚等,而以苯酚、甲酚污染最突出。
苯酚简称酚,又名石炭酸,微酸性(腐蚀性),常温下能挥发,放出一种特殊的刺激性臭味,在空气中变粉红色。医院常用的“来苏水”消毒剂便是苯酚钠盐的稀溶液。
甲酚又称煤酚,与苯酚的化学活性及毒性类似,也经常同时存在。
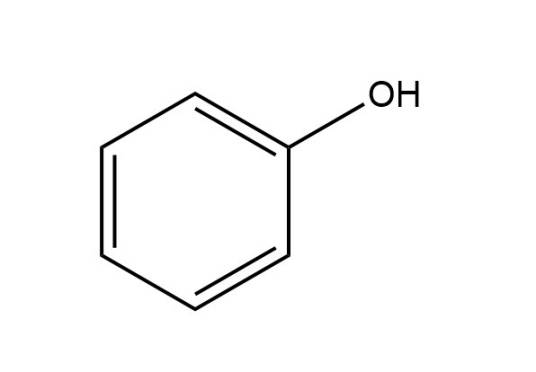
酚类按其芳环上所直接连接的羟基数目的不同,可分为一元、二元酚和多元酚;按其挥发性又可分为挥发酚与不挥发酚。一元酚多具有挥发性(沸点在230℃以内)。 最简单的酚是苯酚,这是一种有特殊气味的无色固体,最早是从煤焦油中发现的,故又俗称为石炭酸(因其有酸性)。
在空气中放置时,许多酚类化合物都是因带有部分氧化产物而呈现粉红色和深棕色,酚分子间及酚与水分子之间也能生成氢键,故其沸点和在水中是溶解性都比分子量相近的芳烃高和大。酚在冷水中的溶解度较少,但与热水可以互溶,也易溶与醇、醚等有机溶剂。主要代表物有:
1、苯酚, 俗称石炭酸,除来源于煤焦油外,还可由氯苯水解或异丙苯氧化等方法制备;有机合成的重要原料,多用于制造塑料、医药、农药、染料等;
2、对苯二酚,无色晶体,易被氧化为对苯醌,可用作显影剂、抗氧化剂、阻聚剂;
3、萘酚,有α、β两种异构体。 α-萘酚和β-萘酚分别与三氯化铁生成紫色和绿色沉淀;可由相应的萘磺酸钠经碱熔而制得。也可在酸性条件下,由萘胺水解得到。
酚类化合物是一种原型质毒物,对一切生活个体都有毒杀作用。能使蛋白质凝固,所以有强烈的杀菌作用。其水溶液很易通过皮肤引起全身中毒;其蒸气由呼吸道吸入,对神经系统损害更大。长期吸入高浓度酚蒸汽或饮用酚污染了的水可引起慢性积累性中毒;吸入高浓度酚蒸汽、酚液或被大量酚液溅到皮肤上可引起急性中毒。如不及时抢救,可在3~8小时内因神经中枢麻痹而残废。慢性酚中毒常见有呕吐,腹泻、食欲不振、头晕、贫血和各种神经系病症。人对酚的口服致死量为530毫克/公斤体重。
酚对水产和微生物、农作物都有一定的毒害。水中含酚0.1~0.2mg/L时,鱼肉即有臭味不能食用;6.5~9.3mg/L时,能破坏鱼的鳃和咽,使其腹腔出血、脾肿大甚至死亡。含酚浓度高于100mg/L的废水直接灌田,会引起农作物枯死和减产。
低级酚都有特殊的刺激性气味,尤其对眼睛、呼吸道粘膜、皮肤等有强烈的刺激和腐蚀作用,在使用时应注意安全保护措施。
酚虽然可以发生 C-O 键和O-H键断裂两类反应,但由于p-π共轭效应,C-O键非常牢固,不易断裂。但是,O-H 键是容易断裂的,因为生成的酚负离子中的负电荷可以离域分散而得以稳定。酚上的苯环则由于上述共轭作用而比苯更容易进行亲电取代反应。
性质介绍
酚,通式为ArOH,是芳香烃环上的氢被羟基(-OH)取代的一类芳香族化合物。最简单的酚为苯酚。酚类化合物是指芳香烃中芳香环上的氢原子被羟基取代所生成的化合物,根据其分子所含的羟基数目可分为一元酚、二元酚和多元酚(三个或三个以上酚羟基)。
酚的羟基直接与苯环的sp2杂化的碳原子相连,这与脂肪族化合物中的烯醇很相似。另外,由于 酚的羟基氧原子的未共用电子对与苯环的共轭作用,不但使苯酚成稳定化合物,而且也有利苯酚的离解。值得注意的是,酚的羟基氧原子杂化类型为不等性sp2杂化,不同于醇羟基氧原子的不等性sp3杂化。
弱酸性
酸性比较:碳酸>苯酚>碳酸氢根>水。
酚比醇的酸性强,是由于酚式羟基的O-H键易断裂,生成的苯氧基负离子比较稳定,使苯酚的离解平衡趋向右侧,而表现弱酸性。酚式羟基的氢除能被金属取代外,还能与强碱溶液生成盐(如酚钠)和水。
若在苯酚钠的水溶液中通入二氧化碳,即有游离苯酚析出。这是因为苯酚酸性比碳酸弱,所以酚盐能被碳酸所分解。
C6H5ONa+CO2+H2O→C6H5OH+NaHCO3
由于酚的酸性弱于碳酸,所以酚只能溶于氢氧化钠而不溶于碳酸氢钠。实验室里常根据酚的这一特性,而与既溶于氢氧化钠又能溶于碳酸氢钠的羧酸相区别。此方法也可用于中草药中酚类成分与羧酸类成分的分离。
傅-克反应
苯酚也容易发生傅-克酰基化和烷基化反应。但是,酚羟基要三氯化铝作用形成铝盐,因此需要用较多的三氯化铝来催化反应,得到对和邻酰基苯酚。邻酰基酚中酚羟基的氢与酰基氧原子之间可以形成氢键,这使它在非极性溶液中的溶解度较大,利用该特性采用重结晶的方法能分离这个异构体。
傅-克反应需要以硝基苯或二硫化碳为溶剂,若以三氟化硼为催化剂,酚和羧酸也能直接反应得到酰基代酚。
苯酚与邻苯二甲酸酐在浓硫酸或无水氯化锌作用下发生上述的酰基化反应,两分子苯酚与一分子酸酐缩合后得到酚酞这一最为常用的酸碱指示剂。酚酞在pH小于8.5的溶液中为无色液体,当pH大于9时,形成电荷离域范围很大的粉红色的共轭双负离子。酚的烷基化反应一般以醇或烯烃在浓硫酸催化下进行,反应不容易控制在单取代阶段。
氧化反应
酚类易被氧化,但产物复杂。纯苯酚系无色结晶,在空气中放置后,就能逐渐氧化变为粉红色、红色或暗红色。苯酚如用酸性重铬酸钾强烈氧化,则生成对苯醌。
邻苯二酚和对苯二酚比苯酚更容易被氧化成相应的醌,但间苯二酚不能被氧化为相应的醌。醌是一般都具有颜色。
显色反应
大多数的酚能与氯化铁的稀水溶液发生显色反应。不同的酚与氯化铁反应呈显不同的颜色。例如苯酚、间苯二酚、1,3,5-苯三酚与氯化铁溶液作用,均显紫色;甲苯酚呈蓝色;邻苯二酚、对苯二酚呈绿色;1,2,3-苯三酚呈红色,α-萘酚为紫色沉淀,β-萘酚则为绿色沉淀等。此显色反应常用以鉴别酚类的存在。
具有羟基与sp2杂化碳原子相连的结构( —C=C—OH)结构的化合物能与FeCl3的水溶液显示特殊的颜色一般的醇式羟基无此反应,故也可用来区别醇与烯醇。
酚 | 苯酚 | 对甲 苯酚 | 间甲 苯酚 | 对苯 二酚 | 均苯 三酚 | 邻苯 二酚 | 对苯 二酚 | 间苯 二酚 | 连苯 三酚 | α-萘酚 | β-萘酚 |
与FeCl3 显色 | 蓝紫色 | 蓝色 | 蓝紫色 | 暗绿色 结晶 | 紫色 | 深绿色 | 绿色 | 蓝紫色 | 淡棕 红色 | 紫红色 沉淀 | 绿色 沉淀 |
取代反应
酚羟基由于p-π共轭而难于被取代,但苯环上的氢原子可被取代,发生卤化、硝化和磺化等反应,并且羟基是邻、对位定位基,对苯环有活化作用,故酚比苯更容易进行亲电取代反应。
1、卤化苯酚水溶液与溴水反应立刻生成三溴苯酚白色沉淀,环境检测中常用来对苯酚定性或定量测定;
2、硝化苯酚在室温下可被稀硝酸硝化,生成邻、对位硝基化合物。使用稀硝酸即可生成邻硝基苯酚和对硝基苯酚的混合物。如使用浓硝酸和浓硫酸的混合物作硝化剂则可生成二硝基苯酚或三硝基苯酚。2,4,6-三硝基苯酚俗称苦味酸,酸性比苯酚强得多。
简介
低浓度酚能使蛋白变性,高浓度能使蛋白沉淀。对皮肤、粘膜有强烈的腐蚀作用,也可抑制中枢神经系统或损害肝、肾功能。水溶液比纯酚易经皮肤吸收,而乳剂更易吸收。吸入的酚大部分滞留在肺内,停止接触很快排出体外。吸收的酚大部分以原形或与硫酸、葡萄糖醛酸或其他酸结合随尿排出,一部分经氧化变为邻苯二酚和对苯二酚随尿排出, 使尿呈棕黑色(酚尿)。人口服致死量报道不一,LD为2~15g,或MLD为140mg/kg,14g/kg。国外报道酚液污染皮肤面积为25%,10分钟死亡,血酚为0.74mmol/L。
临床表现
急性中毒:吸入高浓度蒸气可引起头痛、头昏、乏力、视物模糊、 肺水肿等表现。误服可引起消化道灼伤, 出现烧灼痛,呼出气带酚气味,呕吐物或大便可带血,可发生胃肠道穿孔,并可出现 休克 、肺水肿、肝或肾损害。一般可在48小时内出现急性肾功能衰竭 ,血及尿酚量增高。
皮肤灼伤:创面初期为无痛性白色起皱,继而形成褐色痂皮。常见浅Ⅱ度灼伤。可经灼伤的皮肤吸收,经一定潜伏期后出现急性肾功能衰竭等急性中毒表现。
眼接触:可致灼伤。
中毒处理方法
急性中毒:立即脱离现场至新鲜空气处。皮肤污染后立即脱去污染的衣着,用大量流动清水冲洗至少20分钟; 面积小也可先用50%酒精擦试创面或用甘油、聚乙二醇或聚乙二醇和酒精混合液 (7 : 3) 抹皮肤后立即用大量流动清水冲洗。再用饱和硫酸钠溶液湿敷。口服者给服植物油15~30mL,催吐, 后温水洗胃至呕吐物无酚气味为止,再给硫酸钠15~30mg。消化道已有严重腐蚀时勿给上述处理。早期给氧。合理应用抗生素。 防治肺水肿、 肝、肾损害等对症、支持治疗。糖皮质激素的应用视灼伤程度及中毒病情而定。病情(包括皮肤灼伤)严重者需早期应用透析疗法排毒及防治肾衰。口服者需防治食道瘢痕收缩致狭窄。
眼接触:用生理盐水、冷开水或清水至少冲洗10分钟,对症处理。
酚的制备方法和醇有所不同,主要有以下几类方法。
卤代物的水解
芳香卤代物的水解不如脂肪族卤代物那么容易,一般需要加温加压在工业生产上进行,反应可能是经过苯炔中间体过程。当卤素的邻对为上有吸电子基团存在时,芳环受到缺电活化,使水解反应容易发生。
磺酸盐碱熔法
芳磺酸用亚硫酸钠Na2SO3中和为芳磺酸钠盐再有碱熔融后酸化得到酚。
这是生产苯酚最早的一个方法。反应中要用到强酸强碱,污染大,反应步骤又长,自动话生产率低,当分子中含有羰基、卤素、氨基、硝基等官能团时,在高温生产时还容易受到氧化等副反应的影响,这些因素都限制了这个反应的应用价值。然而,这个反应产率高,纯度也还可以,副产物Na2SO3和SO3可反复使用,设备简单,无论在实验室还是工业上都仍有应用价值,间二苯酚、对甲苯酚、苯酚等产品还主要是由此法产生。
重氮盐水解
芳香烃硝化还原得到苯胺后再制得重氮盐,重氮盐水解后得到苯酚。
目前工业生产苯酚的最主要方法是用异丙苯空气氧化法,该方法除了生成苯酚外,还得到丙酮这一重要工业原料。
4格氏反应
芳香卤代物格氏反应和硼酸酯作用后再水解也是实验室里得到酚的一个好方法。
用纳米二氧化钛(TiO2)粉末,在太阳光(或紫外线)照射下,可以催化降解多种有机化合物,这是一项极有前途的实用废水处理技术。在多云到阴的条件下,光照12小时,含苯酚4.3g·L-1的废水可全部转化为无毒的物质。
在不同取代的酚HMR谱中,羟基上的质子以及芳环上质子的化学位移有明显区别;酚羟基上质子的化学位移范围一般在4~7;对酚羟基上质子化学位移的影响因素有溶剂的性质、浓度、温度、取代基等。能够形成较强的分子内氢键的酚或者环上有强吸电子基的酚,其羟基上质子的化学位移值一般都在10~12左右。
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。