-
砹 编辑
砹(Astatine),是一种非常稀少的天然放射性元素,原子序数85,化学符号源于希腊文"astator",原意是“改变”。1940年美国加州大学伯克利分校科学家得到了砹,发现者包括伯克利教授埃米利奥·吉诺·塞格雷等。已发现质量数196~219的全部砹同位素,其中只有砹215、216、218、219是天然放射性同位素,其余都通过人工核反应合成的。它的所有同位素中最稳定的一个是砹-210,半衰期为8.1小时。
中文名:砹
外文名:Astatine
原子量:210
元素符号:At
形态:固态
发现人:埃米利奥·吉诺·塞格雷
共价半径:150pm
电负性标度:Pauling scale:2.2
导热性:1.7W/(m·K)
CAS号:7440-68-8
熔点:575K
密度:6.2 至 6.5 g/cm³
氧化态:-1,+1,+3,+5,+7
原子序数:85
 砹的化学形态
砹的化学形态
刚开始,化学家们根据门捷列夫的推断——类碘是一个卤素,是成盐的元素,就尝试从各种盐类里去寻找它们,但是一无所获。
1925年7月英国化学家费里恩德特地选定了炎热的夏天去死海,寻找它们。但是,经过辛劳的化学分析和光谱分析后,却丝毫没有发现这个元素。
后来又有不少化学家尝试利用光谱技术以及利用原子量作为突破口去找这个元素,但都没有成功。
1931年,美国亚拉巴马州工艺学院物理学教授阿立生宣布,在王水和独居石作用的萃取液中,发现了85号元素。元素符号定为Ab。可是不久,磁光分析法本身被否定了,利用它发现的元素也就不可能成立。
1940年,意大利化学家埃米利奥·吉诺·塞格雷 发现了第85号元素 ,它被命名为“砹(At)”。在希腊文里,砹(Astatium)的意思是“不稳定”。西格雷后来迁居到了美国 ,和美国科学家科里森、麦肯齐在加州大学伯克利分校用“原子大炮”——回旋加速器加速氦原子核 ,轰击金属铋-209,由此制得了第85号元素——“亚碘”,就是砹。
砹是一种非金属元素,它的性质同碘很相似,并有类似金属的性质。砹很不稳定,它刚出世8.3小时,便有一半砹的原子核已经分裂变成别的元素。
后来,人们在铀矿中也发现了砹。这说明在大自然中存在着天然的砹。不过它的数量极少,在地壳中的含量只有10个亿亿亿分之一,是地壳中含量最少的元素之一。
自然界存在的砹都是天然放射性衰变系的衰变产物。砹的天然放射性同位素有215At、216At、218At和219At等4种。在铀矿物中存在痕量的短寿命的砹同位素;在镭族放射性同位素中进行很微小的分支衰减时,产生一个半衰期为2s的同位素218At;在锕铀系中进行很微小的分支衰减时,产生一个半衰期为0.9s的219At。砹在地壳中的存在量极微少,总量少于28.4g(约1英两)。用人工放射方法已发现质量数在196~219间全部砹同位素。
中文名称 | 砹 |
|---|---|
汉语拼音 | ài |
英文名称 | astatine |
CAS号 | 7440-68-8 |
元素符号 | At |
原子序数 | 85 |
周期系列 | 6 |
族-系列 | ⅦA—卤素 |
密度 | (At2)6.35±0.15g/cm3(r.t) |
莫氏硬度 | 无数据 |
性状 | 状似金属 |
地壳中含量 | 3×10-24% |
相对原子质量 | 210 |
共价半径 | 127pm |
价电子排布 | 4f14 5d10 6s2 6p5 |
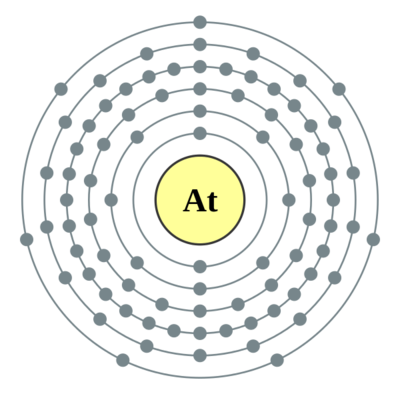
价电子在每能级排布 | 2,8,18,32,18,7 |
电子层 | KLMNOP |
外围电子层排布 | 6s26p5 |
核电荷数 | 85 |
氧化态 | ±1,3,5,7 |
晶体结构 | 面心立方 |
物质状态 | 固态、放射性 |
|---|---|
熔点 | 575K(302℃) |
沸点 | 643K(370℃) |
摩尔体积 | 无数据 |
汽化热 | 无数据 |
熔化热 | 114kJ/mol |
蒸气压 | 无数据 |
声速 | 无数据 |
电负性 | 2.2(鲍林标度) |
比热 | 无数据 |
电导率 | 1.7W/(m·K) |
热导率 | 15W/(m·K) |
第一电离能 | 899.003kJ/mol(估计) |
同位素 | 砹-191至砹-229 |
丰度 | 100% |
半衰期 | 8.1h |
根据卤素的颜色变化趋势,分子量和原子序数越大,颜色就越深。因此,砹将可能成为近黑色固体,它受热时升华成黑暗、紫色气体(比碘蒸气颜色深)。砹是卤族元素中毒性最小、比重最大的元素。(放射性元素毒性都不小)
化合物:砹是镭、锕、钍这些元素自动分裂过程中的产物。砹本身也是放射性元素。砹在大自然中又少又不稳定,寿命很短,这就使它们很难积聚,即使积聚到一克的纯元素都是不可能的,这样就很难看到它的“庐山真面目”。尽管数量这样少,可是科学家却还是制得了砹的同位素20种。
虽然这些化合物主要是理论研究,但也在核医学上也有相关研究。砹有望与金属离子形成离子键,如钠。像其他卤素可以轻易从砹盐中将其置换出来。砹也可以与氢反应,形成砹化氢(HAt),其中当溶解在水中,形成氢砹酸。一些砹化合物实例是:NaAt(砹化钠)、MgAt2(砹化镁)、CAt4(砹化碳)、AgAt(砹化银)。
砹有-1、0、+1、+3、+5、+7六种价态。它在溶液中的化学性质类似碘,当砹以游离元素形式存在于溶液中时,它可以被苯萃取。但实际上砹与碘不同,碘可由I-变为I2,而At-只能变为At0。由于使用和测定砹时其浓度都很小(c=1×10-14mol/L),在这样的低浓度下,双原子形式的砹分子At2是难以形成的。 溶液中的元素砹可以被SO2还原,也可以被溴氧化。在卤族元素中砹最具正电性,它的具有共沉淀特性的氧化态类似于碘离子、游离碘和碘酸离子的氧化态。强氧化剂可使砹产生一个砹酸离子,但得不到高砹酸离子(perastatate),游离的砹极易获得。砹易沉积在铜、铋和银的表面上,也易沉积在含不溶的硫化物的沉淀中和新沉淀的碲元素上,砹这方面的性质和钋相似。玻璃表面对砹的吸附性很弱,以致在室温下,砹的活性因挥发所产生的损耗比由蜕变所产生的还大。
产生的砹也可用湿法提取。即首先将铋靶溶解在硝酸中,然后把过量的硝酸蒸发,剩下来的液体加入盐酸使浓度为8mol/L,后用异丙醚萃取砹。所得的醚萃取液用8mol/L盐酸和1mol/L硝酸清洗,再用0.5mol/L氢氧化钠溶液将砹反萃出来。如果靶子为三氧化二铋,则用含有少量碘的高氯酸溶解靶子,溶解后加人磷酸盐使铋以磷酸铋的形式沉淀下来。或用四氯化碳从高氯酸溶液中将碘和砹萃取出来,最后,用碱溶液将砹从四氯化碳溶液中反萃出来。
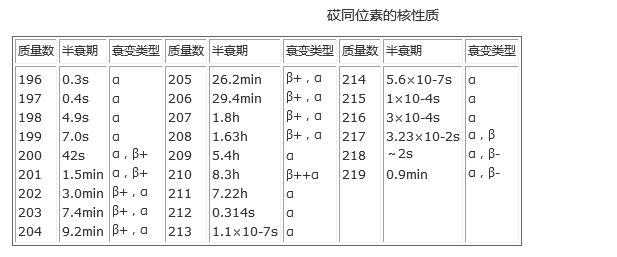 砹同位素的核性质
砹同位素的核性质
资源砹已经用于医疗中。在诊断甲状腺症状的时候,常常用放射性同位素砹-211。砹-211放出的砹射线很强,影响腺体周围的组织。而砹很容易沉积在甲状腺中,能起碘-131同样的作用。它不放射砹射线,放出的砹粒子很容易为机体所吸收。制取砹最方便的方法,是利用加速器制备:
这里的α粒子需要有21-26MeV的能量,如果能量高达29MeV时,则生成210At,能置若增加到60MeV,则生成209At。为了使生成破时靶子的温度不致过高,需要采取冷却措施。
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积:0
7.重原子数量:1
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。