-
锫 编辑
锫(Berkelium)是一种人工合成的放射性化学元素,符号为Bk,原子序为97,属于锕系元素和超铀元素。位于美国加州伯克利的劳伦斯伯克利国家实验室在1949年12月发现锫元素,因此锫以伯克利(Berkeley)命名。锫是继镎(93号)、钚(94号)、镅(95号)和锔(96号)后第五个被发现的超铀元素。最常见的锫同位素是锫-249,主要经高通量核反应炉产生。制造该同位素的有美国田纳西州的橡树岭国家实验室和俄罗斯季米特洛夫格勒的核反应器研究所。第二重要的同位素锫-247要用高能量α粒子向锔-244进行撞击而产生。从1967年到现今,在美国生产的锫元素仅仅超过1克。除在科学研究中用来合成更重的超铀元素和超锕系元素外,锫没有实际的用途。2009年,在进行250天的辐射后,橡树岭国家实验室制成了22毫克的锫-249,并在其后的90天内对该样本进行了纯化处理。纯化后的锫元素同年被送到俄罗斯联合核研究所,以钙-48离子向其撞击150天后,合成了Ts(鿬,117号元素)。锫单质是一种柔软的银白色放射性金属。锫-249同位素辐射的是低能电子,所以相对安全。不过,其半衰期为330天,衰变后会产生锎-249,而该同位素会释放高能量的α粒子,十分危险。这种衰变的现象在研究锫元素及其化合物属性时尤其重要,因为不断生成的锎不但会污染化学样本,还会释放辐射,破坏样本的结构。
中文名:锫
外文名:Berkelium
别名:鉳
化学式:Bk
分子量:247
CAS登录号:7440-40-6
熔点:986 ℃
密度:14.78 g/cm³
外观:柔软的银白色放射性金属
应用:在基础科学研究之外没有实际的用途
质子数:97
常见化合价:+3,+4
电负性:1.3
氧化态:4,3
元素原子量:
 元素周期表
元素周期表
元素类型:金属
氧化态:
Main Bk+4
Other
导热系数:W/(m·K)
10
晶体结构:晶胞为六方晶胞。
晶胞参数:
a = 341.6pm
b = 341.6pm
c = 1106.9pm
α = 90°
β = 90°
γ = 120°
相对原子质量:247.07 (247.0703) (12C = 12.0000)
常见化合价:+3,+4
电负性:1.3
外围电子排布:5f9 7s2
核外电子排布:2,8,18,32,26,9,2
同位素及放射线: Bk-242 Bk-244 Bk-245 Bk-247(放 α) Bk-248 Bk-249 Bk-250 Bk-251
电子亲合和能: 0KJ·mol-1
第一电离能:608KJ·mol-1
第二电离能:0KJ·mol-1
第三电离能:0KJ·mol-1
单质密度:4.78g/cm3
单质熔点:986℃
单质沸点:未知
原子半径:0 埃 离子半径: 埃 共价半径: 0 埃
原子体积/cm3/mol: 离子半径/Å: 0.949
电子模型
共价半径/Å:
电子构型: 1s2 2s2p6 3s2p6d10 4s2p6d10f14 5s2p6d10f9 6s2p6 7s2
发现年代:1949年
元素来源:
锫没有稳定的同位素,自然界不存在。在回旋加速器中用加速的氦核轰击镅-241而获得。
名称由来:
得名于锫的发现地--加利福尼亚州伯克利市(Berkeley)。
元素用途:
没有什么实际用途。
元素辅助资料:
在合成95、96号元素后,经过5年的准备工作,西博格领导的小组在1949年末用高能α粒子轰击镅-241,得到97号元素。
1951年麦克米伦(Edwin Mattison McMillan,1907—)美国人,发现和研究超铀元素镅、锔、锫、锎等。
西博格(Glenn Thedore Seaborg,1912-1999)美国人,发现和研究超铀元素镅、锔、锫、锎等。
1949年12月,格伦·西奥多·西博格、阿伯特·吉奥索和Stanley G. Thompson使用伯克利加州大学的1.5米直径回旋加速器,成功合成并分离出锫元素。在1949至1950年同期被发现的还有锎元素(原子序为98)。
与95和96号元素相似,发现团队为97号元素命名时,也参考了元素周期表中对上的镧系元素的命名方式。95号元素镅(Americium)是以其发现所在的美洲大陆(America)命名的,类似于以欧洲(Europe)命名的铕元素;96号元素锔则是以科学家玛丽·居里(Marie Curie)和皮埃尔·居里(Pierre Curie)命名的,类似于以科学家、工程师约翰·加多林(Johan Gadolin)命名的钆元素。发现团队在报告中写道:“我们建议以发现所在的伯克利城(Berkeley),将第97号元素命名为Berkelium(符号Bk),就像它的化学同系物铽(Terbium,65号)是以矿物发现所在地瑞典伊特比(Ytterby)命名的一样。”
锫的合成过程中最困难的是要产生足够的镅作为目标体,以及要从最终产物中把锫分离出来。首先,铂薄片上要涂上硝酸镅(Am)溶液,在溶液蒸发后,残留物须退火成二氧化镅(AmO2)。科学家再将如此做成的目标体放在位于劳伦斯伯克利国家实验室的1.5米直径回旋加速器中,受能量为35 MeV的α粒子辐射6小时。辐射造成的(α,2n)核反应产生了Bk同位素,另加两颗中子:
辐射完毕之后,科学家把薄片上的涂层溶解在硝酸当中,再用浓氨水使其沉淀为氢氧化锫。离心分离后,产物再次被溶于硝酸中。要从镅中分离出锫,溶液须加入到铵和硫酸铵的混合溶液中并进行加热,使溶解了的镅转化为+6氧化态。剩余未被氧化的镅可以通过加入氢氟酸,以三氟化镅(AmF3)的形式沉淀出来。这一步的产物包括三氟化锔和三氟化锫。该混合物在与氢氧化钾反应后形成对应的氢氧化物,并在最后进行离心分离后溶解在高氯酸中。
层析洗提曲线,能看出镧系的铽(Tb)、钆(Gd)和铕(Eu)与相应锕系的锫(Bk)、锔(Cm)和镅(Am)之间的相近之处。
更进一步的分离过程是在微酸(pH≈3.5)的柠檬酸/铵缓冲溶液中进行的,并使用到高温离子交换法。当时人们并不了解第97号元素的层析特性为何,但可从铽的洗提曲线中推导出来(见图)。最初在洗提产物中探测不出α粒子辐射的特征,但在继续寻找K-α特征X光和转变电子后,科学家终于辨认到了锫元素。在最初的报告中,该新元素的质量数并不确定是243还是244,之后才确定为243。
物理性质
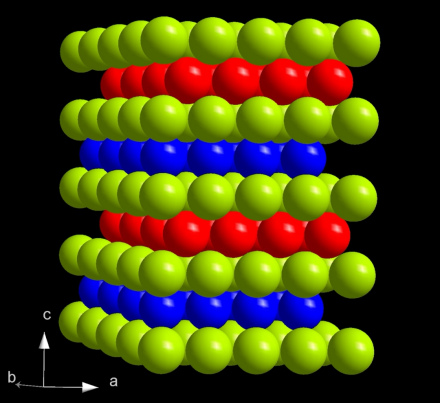 锫晶体结构
锫晶体结构
锫是一种柔软的银白色放射性锕系金属,在元素周期表中位于锔之右,锎之左,镧系元素铽之下。锫的许多物理和化学特性与铽相似。锫的密度为14.78g/cm3,介乎锔(13.52g/cm3)和锎(15.1g/cm3)之间;其熔点(986°C)也高于锔(1340°C),低于锎(900°C)。锫的体积模量(该物质抗衡均匀压力的强度)是锕系元素中相对较低的,大约为20GPa(2×1010Pa)。
由于f轨道电子的内部跃迁,Bk离子会发出萤光,峰值在652纳米(红光)和742纳米(深红光,近红外线)波长处。激发功率和样本的温度会影响这两个峰值的相对亮度。要观察到这一萤光现象,可以把硅酸盐玻璃连同氧化锫或卤化锫一起加热,使锫离子在熔化了的玻璃中分散。
当温度介乎70 K和室温之间时,锫呈居里外斯顺磁性,实际磁矩为9.69玻尔磁子(µB),居里温度为101K。实际磁矩值几乎与简单原子L-S耦合模型计算出的理论值9.72µB相同。当温度降到大约34K的时候,锫会转为呈反铁磁性。锫在标准状态下在氢氯酸中的溶解焓为−600kJ/mol,并可依此推算出水溶Bk离子的标准生成焓(ΔfH°)为−601kJ/mol。Bk3+与Bk间的标准电极电势为−2.01V。中性锫原子的电离电势为6.23eV。
同素异形体
在一般情况下,锫的结构是最稳定的α型。该结构呈六方对称形,空间群为P63/mmc,晶格参数分别为341pm和1107pm。该晶体有着双六方密排结构,层序为ABAC,因此它与α-镧和锔以后的锕系元素的α型晶体同型(具有相似的结构)。这种结构随着压力和温度而变化。在室温下压缩到7GPa时,α-锫会转变为β型,该结构属于面心立方(fcc)对称型,空间群为Fm3m。这种结构转变不会使体积产生变化,但其焓会增加3.66kJ/mol。当继续加压到25GPa时,锫更会转变为属于正交晶系的γ型结构,与α-铀相似。转变后的体积会增加12%,并使5f壳层电子离域。直到57GPa锫都不会再进行相变。
加热后,α-锫会变为面心立方结构(但与β-锫稍有不同),空间群为Fm3m,晶格常数为500pm。这种结构和层序为ABC的密排结构相同。这是一种亚稳态,并会在室温下缓慢地变回α-锫。科学家认为这一相变发生时的温度与锫的熔点非常相近。
化学特性
和所有锕系元素一样,锫可溶于各种无机酸溶液中,并在转化为Bk时释放氢气。这种三价氧化态(+3)特别在水溶液中最为稳定,但另外也存在四价(+4)的锫化合物。二价(+2)锫化合物也有可能存在,但仍不确定。锫的镧系同位素铽也有类似的特性。 Bk在多数酸溶液中都呈绿色,Bk则在氢氯酸中呈黄色,并在硫酸中呈橘黄色。锫在室温下不会与氧发生剧烈反应,这可能是因为它的表面形成了氧化物保护层。另外,锫会与熔化了的金属、氢、各种卤素、氧族元素和氮族元素反应,形成各类二元化合物。
同位素
已知属性的锫同位素共有20中,同核异构体共6种,质量数从235到254不等,全都具有放射性。半衰期最长的有Bk-247(1,380年)、Bk-248(9年)和Bk-249(330天)。其余的同位素半衰期从几微秒到几天不等。锫-249是所有同位素中最容易合成的。它主要释放软β粒子,因此较容易被探测到。锫-249的α辐射非常弱,只有其β辐射的1.45×10%,但也被用于探测该同位素。第二重要的锫同位素是锫-247,它像大部分锕系元素的同位素一样会释放α粒子。
存量
由于所有锫同位素的半衰期都在1,380年以下,远远不足以从地球形成时(数十亿年前)存留到现今。因此所有的原始锫元素(地球形成时存在的锫)现今都已衰变殆尽了。
在地球上,锫主要集聚在几处曾在1945至1980年用于进行核试验的地点,以及一些核事故地点,如切尔诺贝尔核事故、三哩岛核泄漏事故和1968年图勒空军基地B-52坠毁事件等的发生地点。1952年11月1日,美国在埃内韦塔克环礁引爆了代号为常春藤麦克的氢弹。分析显示,爆炸碎片中含有高浓度的各种锕系元素,其中也包括了锫。由于正值冷战,研究结果起初被军方列为机密,直到1956年才被发布。
利用核反应炉产生的锫同位素主要是锫-249。在储存和运载时,大部分的锫会经β衰变变为锎-249。锎-249的半衰期为351年,相对其他在反应炉中产生的同位素来说相当长,所以不可与废料一起弃置。
在含铀量很高的矿藏中,中子捕获和β衰变可以产生几个锫元素的原子,因此锫是自然产生的元素中最罕见的。
同位素的制备
在核反应炉中对铀(U)或钚(Pu)进行中子撞击,可以形成锫。首先,铀燃料经中子捕获(又称(n,γ)反应或中子聚变)变为钚。
钚-239再经中子通量比一般反应炉高几倍的辐射源(如位于美国田纳西州橡树岭国家实验室的85百万瓦特高通率同位素反应炉)照射。高中子通量能够催发多次中子融合反应,把Pu-239转换为Cm-244,然后转换为Cm-249。
锔-249的半衰期很短,只有64分钟,所以不太可能进一步转换为锔-250。不过,锔-249会经β衰变形成Bk-249。
Bk-249半衰期较长,有330天,因此可以再捕获一颗中子。但是产生出来的Bk-250半衰期又非常短,只有3.212小时,所以不可能再变成更重的锫同位素,而是衰变为锎同位素Cf-250:
249Bk+n→250Bk→250Cf+β
虽然Bk-247是锫最稳定的同位素,但是合成该同位素的过程却缺乏效率。这是因为锔-247(原同位素)的衰变率很慢,所以在进行β衰变形成锫-247,就已吸收了更多的中子,形成别的同位素了。因此Bk-249是最容易合成的锫同位素,但其产量仍然微乎其微(美国在1967至1983年间的锫产量总和只有0.66克,每毫克价格高达185美元)。
同位素Bk-247是在1956年以能量为25MeV的α粒子撞击含各种锔同位素的混合物而首次合成的。该同位素和Bk的讯号互相重叠,无法直接辨识,但科学家通过测量衰变产物Cf量的增加,确定了这个新的同位素的存在。同年,科学家以α粒子撞击244Cm,产生了锫-247。
1979年,科学家以10B撞击238U,以11B撞击238U,以14N撞击232Th并且以15N撞击232Th,合成了锫-242。锫-242经电子捕获转变为锔-242,半衰期为7.0±1.3分钟。该实验并没有产生Bk同位素。科学家在后来成功合成了Bk。
分离
锫在液体中有着较稳定的+4氧化态,因此要把锫从别的锕系元素中分离出来会较为简单。核合成会产生大量的锕系元素副产品,这些元素的氧化态主要为+3。在最初进行的实验当中,科学家没有用到这一分离法,而是使用了一种相对复杂的过程。三价锫离子可以被氧化为+4态,可用的氧化剂包括溴酸盐(BrO3-)、铋酸盐(BiO3-)、铬酸盐(CrO42-和Cr2O72-)、过二硫酸银(I)(Ag2S2O8)、二氧化铅(PbO2)和臭氧(O3)等,另也可用光化学氧化过程。制成的四价锫离子再通过离子交换层析法或液态-液态提取法分离出来。液态-液态提取法可使用HDEHP(二(2-乙基已基)膦酸)、各种胺、磷酸三丁酯或其他的各种试剂。这些过程都能将锫从多数三价的锕系元素和镧系元素中分离出来,但铈除外。(镧系元素并不是离子照射后的产物,而是在各种核裂变衰变链中产生的。)
橡树岭国家实验室采用的方法如下:先用氯化锂作为试剂对最初的锕系元素混合物进行离子交换法,再将其沉淀为氢氧化物,过滤后溶解在硝酸中。然后用正离子交换树脂对该溶液进行高压洗提,其中的锫再经由以上的任一方法氧化并提取出来。这个溶液当中几乎没有任何其他的锕系元素(但仍含铈)。把Bk离子还原为Bk之后,可再次用离子交换法把锫从铈中分离出去。
锫金属的制备
位于美国爱达荷州的爱达荷国家实验室于1952年开始了一项计划,以研究固态锫及其化合物的化学及物理属性。Burris B. Cunningham和Stanley G. Thompson于1958年用8克的钚-239作为目标体,在反应炉内对其进行持续6年的放射,最后首次制成了宏观数量的锫元素(0.6微克)。这是唯一一种可用来制造可称量的锫的方法,且大部分实验所用到的固态锫重量都不超过几微克。
世界上主要用来制造锫的放射反应炉是位于美国田纳西州橡树岭国家实验室的80百万瓦特高通率同位素反应炉,以及在俄罗斯季米特洛夫格勒核反应器研究所的SM-2环流反应器。两者都是专门用来制造超锔元素的(原子序超过96的元素),有着相似的功率和通量,对超锔元素的产量也预计相似,但俄罗斯核反应器研究所并不公开他们的生产记录。橡树岭国家实验室的一次常规作业会对数十克锔进行放射,产生约十分之一克锎、数毫克锫-249和锿以及数皮克镄。从1967年到现今在橡树岭生产的锫-249总量仅仅超过1克。
科学家在1971年在1000°C的温度下用气态锂对三氟化锫的还原反应,首次制备了锫金属,共制成1.7微克。他们把三氟化锫悬挂在钨丝上,置于由钽做成的坩埚上方,坩埚装着熔化了的锂。
用四氟化锫也能达到类似的结果。用钍和镧还原四价锫离子,也会形成锫金属。
已知的氧化锫有两种,其中的锫氧化态分别为+3(三氧化二锫,Bk2O3)和+4(二氧化锫,BkO2)。二氧化锫是一种棕色的固体,三氧化二锫则是熔点为1920°C的黄绿色固体,可通过氢分子来还原二氧化锫而取得。
加热到1200 °C后,Bk2O3会进行相变,到1750°C时再进行一次相变。锕系元素的倍半氧化物(三氧化二……)都具有这三种相态。另外,有报告称一氧化锫(BkO)是一种灰色的脆弱固体。
卤化物
锫卤化物中锫的氧化态为+3或+4,其中+3态特别在溶液中最为稳定。科学家只知道四价卤化物BkF4和Cs2BkCl6的固态属性。三氟化锫和三氯化锫中锫原子的配位呈三帽三角菱柱形,配位数为9。在三溴化锫中,锫原子的配位呈二帽三角菱柱形形,配位数为8;或呈八面体形,配位数为6。三碘化锫中的锫配位呈八面体形。
氧化态 | F | Cl | Br | I |
|---|---|---|---|---|
+3 | BkF3 (黄色) | BkCl3 (绿色) Cs2NaBkCl6 | BkBr3 (黄绿色) | BkI3 (黄色) |
+4 | BkF4 (黄色) | Cs2BkCl6 (橙色) | / | / |
四氟化锫(BkF4)是一种黄绿色的离子固体,与四氟化铀和四氟化锆同型。三氟化锫(BkF3)也是种黄绿色的固体,但它有两种晶体结构。较稳定的一种存在于较低温度,与三氟化钇同型;另一种存在于350和600°C之间,与三氟化镧同型。
1962年,科学家首次分离并研究了三氯化锫(BkCl3),其重量只有30亿分之一克。他们首先准备一条温度为500°C,含有氧化锫的中空石英管,再注入氯化氢。制成三氯化锫为绿色固体,熔点在600°C,结构与三氯化铀同型。当加热到接近熔点时BkCl3会进行相变,结构转为属于正交晶系。
已知的三溴化锫共有两种,其中锫的配位数分别为6和8。后者不甚稳定,在加热到大约350°C时会转变为前者。科学家从BkBr3样本刚制成时,持续超过3年利用X光散射技术对该样本进行检测。在这段时间内,一部分的锫-249经过β衰变转变成锎-249,使化合物变为CfBr2。样本的结构并没有随时间变化,但CfBr3可以被氢还原成CfBr2,而BkBr3则不能被还原。科学家又对单独的BkBr3和CfBr3,以及对两者的混合物分别进行了实验,都证实了该项结果。化合物中的锫以每天0.22%的速率衰变为锎,这有碍对锫化合物的研究。除了会干扰化学成分之外,Cf还会释放α粒子,从而对晶体结构造成破坏,并使样本自然加热。要消除化学成分变化的影响,可以在不同时间对样本进行测量,并依此推算出所需的数值。
其他无机化合物
锫-249可以和氮、磷、硒和锑分别形成BkX型的化合物。这些化合物的晶体结构属于立方晶系,可在高温(约600°C)、高真空环境下使三氢化锫(BkH3)或锫金属与这些元素反应而制得。
三硫化二锫(Bk2S3)是一种棕黑色晶体。在1130°C使氧化锫与硫化氢和二硫化碳的气态混合物反应,或使锫金属直接和硫反应,都可以形成三硫化二锫。
在1摩尔浓度的氢氧化钠溶液中,氢氧化锫(III)和氢氧化锫(IV)都是稳定的。磷酸锫(III)(BkPO4)是一种固体,并在绿光照射下会有强烈的荧光反应。要制备氢化锫,须使锫金属和氢气在大约250°C的温度下反应。氢化锫的化学式中,氢的系数不是整数:BkH2+x(0<x<1)。锫还有几种其他的盐,包括硫氧化锫(Bk2O2S)以及水合硝酸锫(Bk(NO3)3·4H2O)、水合氯化锫(BkCl3·6H2O)、水合硫酸锫(Bk2(SO4)3·12H2O)和水合草酸锫(Bk2(C2O4)3·4H2O)。Bk2(SO4)3·12H2O在600 °C温度下于氩气中(为避免氧化成BkO2)经热分解后,会产生硫氧化锫(III)晶体(Bk2O2SO4)。该化合物在惰性环境里在1000 °C以下不会热分解。
有机锫化合物
锫能形成三角形(η–C5H5)3Bk茂金属,含有三个环戊二烯基团。合成方法是在70°C下使三氯化锫与熔化了的二茂铍(Be(C5H5)2)反应。该化合物呈琥珀色,密度为2.47g/cm3,在250°C以下不会热分解,并在大约350°C升华。由于锫具有高放射性,所以这种化合物在几个星期之内便会自行破坏。(η–C5H5)3Bk当中的一个环戊二烯基可以被取代为氯原子,形成2。该化合物的吸收光谱与(η–C5H5)3Bk的相似。
 用来合成117号的硝酸锫,溶于水中
用来合成117号的硝酸锫,溶于水中
1、本站所有文本、信息、视频文件等,仅代表本站观点或作者本人观点,请网友谨慎参考使用。
2、本站信息均为作者提供和网友推荐收集整理而来,仅供学习和研究使用。
3、对任何由于使用本站内容而引起的诉讼、纠纷,本站不承担任何责任。
4、如有侵犯你版权的,请来信(邮箱:baike52199@gmail.com)指出,核实后,本站将立即删除。






























